 |
Главная |
Основное уравнение MKT идеального газа
|
из
5.00
|
p=hFiS=1/3*nm0hυ 2i.(1)
Так как средняя кинетическая энергия поступательного движения молекулы hWKi=m0hυ 2i/2, то
P = 2/3*nhWкi.(2)
Уравнение (1) и эквивалентное ему уравнение (2) называется основным уравнением молекулярно-кинетической теории газов.
Оно связывает макропараметр p с микропараметром hWKi (или hυ2i) и показывает, что понятие давления имеет смысл средней величины и неприменимо к отдельной молекуле.
12. Температура характеризует состояние теплового равновесия системы и является мерой кинетической энергии молекул. Абсолютная температура T (по шкале Кельвина) связана с температурой t (по шкале Цельсия) соотношением T = 273+t .
(температура характеризует скорость движения молекул внутри физического тела.)
13. Зако́н Ша́рля или второй закон Гей-Люссака — один из основных газовых законов, описывающий соотношение давления и температуры для идеального газа.
14. Температура, определяемая равенством (2), называется абсолютной температурой. Абсолютная температура ? не может быть отрицательной, так как слева в равенстве (2) стоят заведомо положительные величины (точнее, она не может быть разных знаков, она может быть либо положительной, либо отрицательной. Это зависит от выбора знака постоянной k. Так как условились температуру тройной точки считать положительной, то абсолютная температура может быть только положительной). Следовательно, наименьшее возможное значение температуры Т = 0 есть температура, когда давление или объем равны нулю.
Предельная температура, при которой давление идеального газа обращается в нуль при фиксированном объеме или объем идеального газа стремится к нулю (т.е. газ как бы должен сжаться в "точку") при неизменном давлении, называется абсолютным нулем. Это самая низкая температура в природе.
Из равенства (3), учитывая, что

вытекает физический смысл абсолютного нуля: абсолютный нуль — температура, при которой должно прекратиться тепловое поступательное движение молекул. Абсолютный нуль недостижим.
15. авление - это явление когда частицы (молекулы) "давят" на сосуд (под действием внутренней энергии и теплового беспорядочного движения ударяются в стенки сосуда). Чем больше кинетическая энергия частицы тем больше сила удара об стенку приходящаяся на единицу площади, тем больше давление.
16. Число Авгадро показывает число молекул в 1 моль вещества. 6,02* 10 в 23 степени
17. Универса́льная га́зовая постоя́нная (также — постоянная Менделеева)— термин, впервые введённый в употребление Д. Менделеевым в 1874 г. Численно равна работе расширения одногомоля
идеального газа в изобарном процессе при увеличении температуры на 1 К. В Международной системе единиц (СИ) универсальная газовая постоянная равна[3] Дж⁄(моль∙К).
Дж⁄(моль∙К). 18. Постоя́нная Бо́льцмана (  или
или 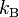 ) — физическая постоянная, определяющая связь между температурой и энергией. k=1{,}380\,648\,8(13)\times 10^{-23} Дж/К[1].
) — физическая постоянная, определяющая связь между температурой и энергией. k=1{,}380\,648\,8(13)\times 10^{-23} Дж/К[1].
19. pV=nRT.где n - число молей газа, R = 8,31431 Дж/моль.К) - газовая постоянная. Для 1 моля газа pv=RT, где v-молярный объем. Клапейрона-Менделеева уравнение записывают также в форме: pV=NkT, где N - число частиц газа в объеме V, k - постоянная Больцмана.
20.
21. Парциальное давление — давление, которое имел бы газ, входящий в состав газовой смеси, если бы он один занимал объём, равный объёму смеси при той же температуре.
22. Изобарный процесс (от греч. «барос» — вес, тяжесть) — процесс изменения состояния термодинамической системы при постоянном давлении (P = const)
2. Изохорный процесс (от греч. хора — занимаемое место) — процесс изменения состояния термодинамической системы при постоянном объёме (V = const).
3. Изотермический процесс (от греч. «термос» — тёплый, горячий) — процесс изменения состояния термодинамической системы при постоянной температуре (T = const). изопроцессы — термодинамические процессы, в которых зна-чение одного из макроскопических параметров остаётся неизменным
23. Важной характеристикой термодинамической системы является ее внутренняя энергия U — энергия хаотического (теплового) движения микрочастиц системы (молекул, атомов, электронов, ядер и т. д.) и энергия взаимодействия этих частиц.
24. Объединяя законы Бойля - Мариотта и Гей-Люссака (уравнения 1 и 2), можно получить следующее уравнение: 
25. Различают Микропараметры иМакропараметры состояния.
К микропараметрам состояния можно отнести следующие физические величины: массу M0 молекул, их скорость, среднюю квадратичную скорость молекул, среднюю кинетическую энергию молекул, среднее время между соударениями молекул, длину их свободного пробега и др. Это такие параметры, которые можно отнести и к одной молекуле макросистемы.
Макропараметры состояния характеризуют только равновесную систему в целом. К ним относятся объем V, давление P, температура T, плотность à, концентрация N, внутренняя энергия U, электрические, магнитные и оптические параметры. Значения этих параметров могут быть установлены с помощью измерительных приборов.
26. Масса одного моля вещества равна его молекулярной массе, но выражена в граммах. Масса одного моля вещества называется молярной массой и обозначается – M. Относительной молекулярной массой М, вещества называется величина, равная отношению средней массы молекулы естественного изотопического состава вещества к 1/12 массы атома углерода 12С.
27. P = F/S где F-сила, ньютон, Н; S- площадь, m2 Единица 1 Н/м2 = 1 Па, а 1 атм = 101325 Па, внесистемная единица давления "бар" равна 105 Па. Ртутный барометр (в). Высота мениска (б). U-образный барометр с отрытым коленом (в) и U-образный дифбарометр
28.
Эмпирическая температура — это температура, измеренная в выбранной температурной шкале.
В термодинамике даётся определение температуры (см. ниже), которое не зависит от выбора термометрического свойства, использованного для её измерения (абсолютная температура)[5].
Абсолютную температуру, измеренную в температурной шкале Кельвина (см. ниже) называют абсолютной термодинамической температурой, или просто термодинамической температурой[6][7].
На практике, если речь идёт о численном значении абсолютной термодинамической температуры, для краткости говорят просто об абсолютной температуре объекта.
29.
30. Изопроцессы описываются очень простыми законами Бойля — Мариотта, Гей-Люссака и Данное утверждение называется законом Бойля — Мариотта.
Записав закон Бойля — Мариотта в виде
p =const/V можно дать и такую формулировку: в изотермическом процессе давление газа обратно про-порционально его объёму ШарляА
отсюда теперь — ввиду произвольности выбора состояний! — получаем закон Гей-Люссака:V/T= const: (5)
Иными словами, при постоянном давлении газа его объём прямо пропорционален температуре :V = const T:
Ввиду произвольности выбора состояний мы приходим к закону Шарля: p/T= const: (8)Иными словами, при постоянном объёме газа его давление прямо пропорционально темпе-ратуре:p = const T
31. Пр
32. Пр
33. Пр
34. E=\frac{3}{2}k*T;\\ Где k - постоянная Больцмана, равна 1,38*10^-23 Дж*К
35. А вот теперь, если мы приравняем правые части и выразим из них скорость и возьмем квадрат,Число Авогадро на массу молекулы , получается Молярная масса  то у нас и получится формула для средней квадратичной скорости молекулы газа:
то у нас и получится формула для средней квадратичной скорости молекулы газа: 
36.
|
из
5.00
|
Обсуждение в статье: Основное уравнение MKT идеального газа |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

