 |
Главная |
Ковалентная связь (КС). Условия образования ковалентной связи, механизмы образования, свойства связи, критерий прочности
|
из
5.00
|
КС – связь, осуществляемая за счет электронной пары, принадлежащей обоим атомам.
Условия образования КС: она образуется между атомами с высокой электроотрицательностью. (электоротр-ть – способность атомов притягивать к себе электроны).
∆Χ – разность электроотрицательности 2-х атомов, если ∆Χ≤1.4, связь полярная
КС м.б. образована:
1 – между любыми атомами неметаллов (т.к. у всех неметаллов высокие значения электроотр-ти), пр: HCl, значения электроотр-ти – по таблицам, у Н=2.1, у Cl=3.1, - ∆Χ=3.1-2.1=1≤1.4, это связь ковалентная и полярная.
2 – между атомами неметалла и металла, если металл находится в высокой степени окисления, пр: CrCl6 дляCr=2.4, ∆Χ=3.1-2.4=0.7≤1.4 - это ковалентная полярная связь.
Механизмы образования КС:
1- обменный механизм - 2 атома обмениваются электронами, образуя общую электронную пару, принадлежащую обоим и называемую «поделенная». Примером могут служить молекулы летучих неорганических соединений: НСl, Н2О, Н2S, NН3 и др. Образование молекулы НСl можно представить схемой Н.+ .Сl: = Н :Cl: Электронная пара смещена к атому хлора, так как относительная электроотрицательность атома хлора (2,83) больше, чем атома водорода (2,1).
2 – донорно-акцепторный механизм: - заключается в том, что пара электронов одного атома (донора) занимает свободную орбиталь другого атома (акцептора) Рассмотрим в качестве примера механизм образования иона аммония 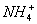 . В молекуле аммиака атом азота имеет неподеленную пару электронов двухэлектронное облако):
. В молекуле аммиака атом азота имеет неподеленную пару электронов двухэлектронное облако):  .
.
У иона водорода свободна (не заполнена) 1s-орбиталь, что можно обозначить как □H+. При образовании иона аммония двухэлектронное облако азота становится общим для атомов азота и водорода, т.е. оно превращается в молекулярное электронное облако. А значит, возникает четвертая ковалентная связь. Процесс образования иона аммония можно представить схемой

| + □H+ → | 
|
Заряд иона водорода становится общим (он делокализован, т.е. рассредоточен между всеми атомами), а двухэлектронное облако (неподеленная электронная пара), принадлежащее азоту, становится общим с водородом.
Ковалентная связь бывает полярной (сложные молекулы) и неполярной (простые молекулы).
Свойства ковалентной связи
Ковалентная связь обладает рядом важных свойств. К их числу относятся: насыщаемость и направленность.
Насыщаемость — характерное свойство ковалентной связи. Она проявляется в способности атомов образовывать ограниченное число ковалентных связей. Это связано с тем, что одна орбиталь атома может принимать участие в образовании только одной ковалентной химической связи. Данное свойство определяет состав молекулярных химических соединений. Так, при взаимодействии атомов водорода образуется молекула Н2, а не Н3. Третий атом водорода не может присоединиться, так как спин его электрона окажется параллельным спину одного из спаренных электронов в молекуле. Способность к образованию того или иного числа ковалентных связей у атомов различных элементов ограничивается получением максимального числа неспаренных валентных электронов.
Направленность — свойство ковалентной связи, определяющее геометрическую структуру молекулы. Причина направленности связи заключается в том, что перекрывание электронных орбиталей возможно только при их определенной взаимной ориентации, обеспечивающей наибольшую электронную плотность в области их перекрывания. В этом случае образуется наиболее прочная химическая связь.
|
из
5.00
|
Обсуждение в статье: Ковалентная связь (КС). Условия образования ковалентной связи, механизмы образования, свойства связи, критерий прочности |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

