 |
Главная |
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
|
из
5.00
|
Вопросы и задачи для подготовки к письменному экзамену по химии
Дисциплина ХИМИЯ. Курс 1
Специальности А, ДМ, АМ, ТВ, ДВС, АЭ, ГП
СТРОЕНИЕ ВЕЩЕСТВА
1.Общие представления о строении атома.
2.Двойственная природа электрона (корпускулярно-волновой дуализм). Понятие о состоянии электронов в атомах: размер, форма и ориентация орбиталей, спин электрона.
3.Принцип Паули. Максимальное возможное число электронов на энергетических уровнях и подуровнях (s, p, d, f ). Элементы s-, p-, d- электронных семейств, их особенности.
4.Порядок заполнения орбиталей данного энергетического подуровня (правило Гунда). Электронные формулы элементов.
5.Периодический закон Д.И. Менделеева. Структура периодической системы и ее связь со строением атомов элементов.
6.Энергия связи внешних электронов с ядром атома (энергия ионизации, сродство к электрону, электроотрицательность) и закономерности изменения этой энергии в периодах и группах периодический системы.
7.Механизм образования ионной и ковалентной химической связь.
8.Основные характеристики химической связи: энергия, длина, направленность, насыщенность.
9.Гибридизация орбиталей. Примеры гибридизации в соединениях бериллия, бора и углерода.
10. Приведите электронную конфигурацию атома углерода в нормальном и возбужденном состояниях.
11. Укажите тип гибридизации и валентный угол в молекулах ВеН2, H2O, AlН3, AlF3, СО2, CН4, С2Н4, С2Н2.
12.Приведите электронную конфигурацию атомаAlи определите, к какому электронному семейству относится данный элемент. Приведите формулы соединений Al с кислородом и водородом. Укажите, какими свойствами обладает оксид алюминия ?
13. Укажите, в каких из приведенных веществ K2S, NH3, NaCl, H2, H2O имеет место полярная ковалентная связь.
14. Укажите характер химической связи в ряду NaCl – HCl – Cl2 .
15. Составьте орбитальную схему строения молекулы Н2О. Объясните, почему угол между связями в молекуле Н2О > 90о?
16. Объясните механизм образования 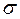 - и
- и 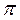 - связей на примере молекулы азота N2 .
- связей на примере молекулы азота N2 .
Литература
1. Литманович А.А. и др. Строение атома и химическая связь: учебное пособие./ А.А. Литманович. М.: МАДИ (ГТУ), 2009.
2.Коровин Н.В. Общая химия, Высшая школа, 2003, раздел 1, гл. 1, §§ 1.1- 1.5; гл. 2 §§ 2.1 –2.3; гл.3 § 3,2.
РАСТВОРЫ
1.Растворы: признаки химических соединений и механических смесей, тепловой эффект растворения.
2.Способы выражения концентрации растворов. Молярная, молярная концентрация эквивалента вещества, моляльная и процентная концентрации. Титр.
3.Законы Рауля. Изменение температуры кипения и замерзания раствора в сравнении с чистым растворителем. Определение молекулярной массы растворенного вещества.
4. Рассчитайте, при какой температуре будет кристаллизоваться 40 % - ный водный раствор этилового спирта?
5. Рассчитайте молярную массу неэлектролита, зная, что раствор, содержащий 2,5 г этого вещества в 250 г воды, замерзает при температуре – 0,3 °С. Крископическая константа воды 1,86 кг · К· моль-1.
6. Рассчитайте, сколько граммов этилового спирта (С2Н5ОН) и воды необходимо взять для приготовления 1000 граммов раствора, незамерзающего до - 30 оС ?
7. Смешали 200 г глюкозы с массовой долей растворенного вещества 20 % и 300 г раствора с массовой долей 10%. Рассчитайте массовую долю вещества в полученном растворе в %.
8. Вычислите, сколько мл 3 % - ного раствора НСl ( 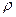 =1,0132 г/см3 ) необходимо для приготовления 250 мл раствора НСl с молярной концентрацией 0,2 моль/л.
=1,0132 г/см3 ) необходимо для приготовления 250 мл раствора НСl с молярной концентрацией 0,2 моль/л.
9. Рассчитайте объем раствора КОН с молярной концентрацией эквивалента 0,1 моль экв/л, необходимый для нейтрализации 20 мл раствора НNO3 с молярной концентрацией 0,15 моль экв/л .
10.Определить молярную концентрацию эквивалента (Сэк) и титр (Т) раствора H2SO4 , если на титрование 10 мл этого раствора затрачен 1 мл раствора с концентрацией Сэк = 0,5 моль экв/л.
Литература:
1. Методическое пособие ч.II М.: МАДИ (ГТУ), 2005, с. 3 – 31.
2. Коровин Н.В. Общая химия, М., Высшая школа, 2003, гл.8.
ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА
1.Статистические характеристики систем, состоящих из большого числа частиц. Понятие о функции состояния системы и основные свойства таких функций.
2.Первый закон термодинамики. Внутренняя энергия и энтальпия как функции состояния системы. Стандартное состояние и стандартные значения энергии и энтальпии.
3.Стандартная энтальпия образования вещества. Зависимость энтальпии простого вещества от температуры и агрегатного состояния.
4.Расчет тепловых эффектов химических реакций: законы Лавуазье-Лапласа и Гесса.
5.Термодинамическая вероятность как мера беспорядка в системе. Уравнение Больцмана. Энтропия как функция состояния системы и характер ее изменения при изменении основных параметров системы (агрегатное состояние, концентрация, объем, давление, температура). Второй закон термодинамики.
6.Энергия Гиббса. Направление самопроизвольного протекание реакции при стандартных условиях и критерий равновесия системы.
7. Равновесие в термодинамической системе. Константа химического равновесия.
8. Не производя расчетов, определите знак изменения энтропии в реакции:
2 H2S(г) + 3 O2 (г) = 2 H2O(ж) + 2 SO2 (г).
Рассчитайте изменение энтропии для стандартных условий и сравните с результатом оценки.
9.Рассчитайте количество теплоты, выделяющееся при полном сгорании 1 кг этилена (С2Н4), взятого в газообразном состоянии, если в результате реакции образуется углекислый газ и Н2О(г).
10. Вычислите, сколько теплоты выделится при полном сгорании 165 л ацетилена, взятого при н.у. : С2Н 2 (г) + 2,5 O2 (г) = 2 СO2 (г) + H2О (г).
11. Установите возможность протекания реакции 2 SO3 (г) = 2 SO2 (г) + O2 (г) при стандартных условиях и температуре Т = 800 К (зависимостью  Hp и
Hp и  Sр от температуры пренебречь).
Sр от температуры пренебречь).
12. Для плавления 1,8 г льда потребовалось 567 Дж теплоты. Рассчитайте молярную теплоту плавления льда.
13. Определите константу равновесия (Кр) реакции SnO(к) + СО(г) ↔ Sn(к) + СО2 (г) при стандартной температуре. Рассчитайте концентрационную константу равновесия Кс и равновесные концентрации газообразных веществ, если исходная концентрация оксида углерода была [CO]0 =1 моль/л.
Литература:
| 1. Методическое пособие “Основы химической термодинамики”, М.: МАДИ (ГТУ), 2002, с. 3-44. 2. Коровин Н.В. Общая химия, Высшая школа, 2003, раздел 21, гл. 5. |
ХИМИЧЕСКАЯ КИНЕТИКА
1.Гомогенные и гетерогенные реакции. Простые и сложные реакции, понятие об элементарной реакции.
2. Сложные реакции: понятие об активных частицах (свободные радикалы, ионы); механизм сложных реакций на примере реакции водорода с бромом.
3. Скорость реакции. Средняя и истинная скорости.
4. Константа скорости реакции, ее размерность. Молекулярность реакции. Кинетический порядок реакции по веществу.
5.Зависимость скорости от концентрации веществ для гомогенных простых реакций (дифференциальное кинетическое уравнение).
6. Интегральное кинетическое уравнение. Изменение концентрации реагирующих веществ во времени (на примере мономолекулярной реакции).
7.Зависимость скорости реакции от температуры. Понятие об эффективных столкновениях и активных молекулах. Энергия активации реакции. Уравнение Аррениуса: физический смысл констант этого уравнения.
8. Химические равновесия с позиций представлений химической кинетики. Константа химического равновесия.
9. Обратимые реакции. Смещение химического равновесия (принцип Ле Шателье).
10. Каталитические реакции.
11. Как изменится начальная скорость простой (тримолекулярной) химической реакции 2NO(г) + O2(г) → 2NО2(г), если: а) увеличить исходную концентрацию О2 в 2 раза; б) увеличить исходную концентрацию NO в 2 раза?
12. На основании принципа Ле Шателье определите, в каком направлении сместится равновесие в системе:
4 HCl (Г) + O2 (Г) 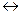 2 H2O(Г) + 2 Cl2 (Г) ,
2 H2O(Г) + 2 Cl2 (Г) ,  Hop = - 124, 2 кДж
Hop = - 124, 2 кДж
при повышении: а) давления (Т = const); б) температуры.
Напишите выражение константы равновесия для данной реакции.
14. Определите константу равновесия реакции: FeO(к) + CO(г) 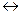 Fe(к) + CO2 (г)
Fe(к) + CO2 (г)
при Т = 1040 К и равновесные концентрации газообразных веществ, если исходная концентрация оксида углерода равна [CO]o = 5 моль/л (SoFe = 27,3 Дж/моль  К ).
К ).
15. Реакция А = С + D описывается кинетическим уравнением первого порядка. Константа скорости этой реакции равна 1,2 . 10 –2 с –1. Рассчитайте время, за которое разложится 65 % вещества А .
16. Для реакции АВ (г) 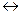 А (г) + В (г) константа равновесия равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Рассчитайте начальную концентрацию вещества АВ.
А (г) + В (г) константа равновесия равна 0,04, а равновесная концентрация вещества В составляет 0,02 моль/л. Рассчитайте начальную концентрацию вещества АВ.
17. Определите энергию активации реакции, для которой при температуре Т1 = 227о С константа скорости равна k1 = 1,2 сек-1, а при Т2 = 427о С - k2 = 1,2×103 cек-1.
18. Энергия активации некоторой реакции в отсутствии катализатора равна 75,2 кДж/моль, а с катализатором – 50,1 кДж/моль. Рассчитайте, во сколько раз возрастет скорость реакции в присутствии катализатора, если реакция протекает при 25 оС ?
19. Вычислите равновесные концентрации веществ в обратимой реакции:
H2 (г) + J2 (г) 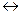 2 HJ(г),
2 HJ(г),
если исходные концентрации водорода и йода составляли 1,2 и 0,8 моль/л соответственно. Известно, что в реакцию вступило 50 % водорода.
20. Дана обратимая химическая реакция CH4 (г) + H2O(г) 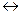 CO(г) + 3 Н2 (г). Энергия активации в прямом направлении составляет
CO(г) + 3 Н2 (г). Энергия активации в прямом направлении составляет 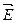 а = 250 кДж/моль. Определите энергию активации реакции в обратном направлении
а = 250 кДж/моль. Определите энергию активации реакции в обратном направлении 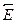 a.
a.
21. Укажите, как изменится скорость гетерогенной реакции А(ТВ) + В(Ж) = С(Ж) при увеличении поверхности твердого вещества? Напишите выражение для константы равновесия.
Литература:
| 1. Учебное пособие “Основы химической кинетики”, М.: МАДИ (ГТУ), 2007, с. 3-45. 2.Коровин Н.В. Общая химия, Высшая школа, 2003, раздел 2, гл. 7. |
РАСТВОРЫ ЭЛЕКТРОЛИТОВ
1.Особенности растворов электролитов.
2. Механизм электролитической диссоциации. Сильные и слабые электролиты. Понятие об активности сильного электролита.
3.Степень и константа диссоциации слабого электролита: зависимость степени диссоциации от концентрации электролита.
4.Ионное равновесие в растворах слабых электролитов. Смещение равновесия.
5.Ионные равновесия в растворах амфотерных гидроксидов, смещение равновесия.
6.Особенности равновесия в растворах малорастворимых сильных электролитов. Произведение растворимости, понятие о насыщенных растворах.
7.Электролитическая диссоциация воды. Водородный показатель (рН) раствора и способы его определения.
8.Гидролиз солей. Примеры гидролиза солей.
9.Определите константу диссоциации гидроксида аммония (NH4OH), концентрацию ионов [ОН-], [Н+] и значение рН этого раствора с концентрацией [NH4OH] = 0,02 моль/л. Степень диссоциации гидроксида в этом растворе 3 %.
10.Определите степень диссоциации ( 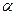 ) цианистоводородной кислоты НСN, концентрацию ионов [Н+] и значение рН раствора этой кислоты с концентрацией 0,1 моль/л. Константа диссоциации НСN составляет Кд = 1,8
) цианистоводородной кислоты НСN, концентрацию ионов [Н+] и значение рН раствора этой кислоты с концентрацией 0,1 моль/л. Константа диссоциации НСN составляет Кд = 1,8 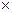 10-4 .
10-4 .
11. Растворимость карбоната серебра Ag2CO3 в воде равна 1,3 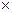 10-4 моль/л. Определите концентрации ионов [Ag+] и [CO32-] в насыщенном растворе и значение ПР этой соли.
10-4 моль/л. Определите концентрации ионов [Ag+] и [CO32-] в насыщенном растворе и значение ПР этой соли.
12. Определите константу диссоциации сернистой кислоты H2SO3 по первой ступени, если в растворе кислоты с концентрацией 0,1 моль/л степень диссоциации кислоты по первой ступени составляет 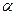 = 34 %. Каково значение рН этого раствора (диссоциацией кислоты по второй ступени пренебречь)?
= 34 %. Каково значение рН этого раствора (диссоциацией кислоты по второй ступени пренебречь)?
13. Определите возможность образования осадка при смешении 1 мл раствора соли Pb(NO3)2 с концентрацией 0,2 моль/л и 2 мл раствора NaCl с концентрацией 0,01 моль/л. Произведение растворимости PbCl2 равно 1,7  10-5 .
10-5 .
14. Определите растворимость (в моль/л) соли PbCl2 в воде и концентрацию ионов [Pb2+] и [Cl-] в насыщенном растворе, если для этой соли ПР = 2,12 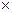 10-5.
10-5.
15. Напишите по стадиям уравнения гидролиза солей NaHSO3, FeCl3, NH4CN , K2S , NaF и Cu(OH)Cl в молекулярной и сокращенной ионной форме. Укажите характер среды (рН ) в растворах этих солей и объясните, до какой стадии реально протекает гидролиз.
16. Напишите уравнения электролитической диссоциации H2CO3, Al(OH)3 и выражения для констант диссоциации по каждой ступени.
Литература :
| 1.Методическое пособие ч.II М.: МАДИ (ГТУ), 2005, с. 32-66. 2.Коровин Н.В. Общая химия, Высшая школа, 2003, раздел 3, гл. 8., § 8.1, §§ 8.3 - 8.6. |
|
из
5.00
|
Обсуждение в статье: ХИМИЧЕСКАЯ ТЕРМОДИНАМИКА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

