|
Главная |
ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. УГЛЕВОДОРОДЫ
|
из
5.00
|
Б-4-АЛКАНЫ
Предельные углеводороды (алканы) – это соединения углерода с водородом, в молекулах которых атомы углерода соединены между собой одинарными сигма-связями, а все остальные валентности «насыщены» атомами водорода.
Простейшим представителем алканов является метан – СН4, который является родоначальником гомологического ряда алканов.
Гомологи – это органические соединения, сходные по строению и химическим свойствам, но отличающиеся по составу на группу СН2.
Общая формула: R-H или СnН2n+2,
где R – предельный радикал.
Гомологический ряд.
|  ковалентные σ-связи с другими атомами – в молекуле метана с атомами водорода. Длина
С-С-св.= 0,154нм, Еразр=350 кДж/моль
Физические свойства: Метан – газ без цвета, без запаха, без вкуса, легче воздуха, нерастворим в воде, взрывоопасен.
Химические свойства:
1. Горит: СН4 + 2О2 → СО2 + 2Н2О + Q
2. подвергается каталитическому окислению, в зависимости от катализатора могут быть получены:
а) 2СН4 + О2 ковалентные σ-связи с другими атомами – в молекуле метана с атомами водорода. Длина
С-С-св.= 0,154нм, Еразр=350 кДж/моль
Физические свойства: Метан – газ без цвета, без запаха, без вкуса, легче воздуха, нерастворим в воде, взрывоопасен.
Химические свойства:
1. Горит: СН4 + 2О2 → СО2 + 2Н2О + Q
2. подвергается каталитическому окислению, в зависимости от катализатора могут быть получены:
а) 2СН4 + О2  2СН3ОН (метанол)
б) СН4 + О2 2СН3ОН (метанол)
б) СН4 + О2  НСОН + Н2О
метаналь
в) СН4 + О2 НСОН + Н2О
метаналь
в) СН4 + О2  НСООН + Н2↑
3. Подвергаются термическому разложению:
а) полное: СН4 НСООН + Н2↑
3. Подвергаются термическому разложению:
а) полное: СН4   + 2Н2↑
б) неполное: 2СН4 + 2Н2↑
б) неполное: 2СН4   + 3Н2↑
4. Вступают в реакции замещения с галогенами: СН4 + Cl2 + 3Н2↑
4. Вступают в реакции замещения с галогенами: СН4 + Cl2  СН3Cl + НCl
Реакция идет по свободно-радикальному механизму до полного замещения атомов водорода.
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного. СН3Cl + НCl
Реакция идет по свободно-радикальному механизму до полного замещения атомов водорода.
При хлорировании или бромировании алкана с вторичными или третичными атомами углерода легче всего идет замещение водорода у третичного атома, труднее у вторичного и еще труднее у первичного.
  5.Нитрование алканов (реакция Коновалова) 5.Нитрование алканов (реакция Коновалова)
| Получение: 1.Из нефти.
2.Крекинг высших алканов:
C8H18  C4H8 + C4H10.
3. Реакция Вюрца:
2СН3-Cl +2Na C4H8 + C4H10.
3. Реакция Вюрца:
2СН3-Cl +2Na  С2Н6+2NaCl
4. Реакция Кольбе:
2CH3COONa+2H2O С2Н6+2NaCl
4. Реакция Кольбе:
2CH3COONa+2H2O  C2H6+Na2CO3+ 2H2
5. Прямой синтез:
С+2Н2
C2H6+Na2CO3+ 2H2
5. Прямой синтез:
С+2Н2  2СН4
6. Сплавление со щелочью (реакция Дюма)
СН3СООNa + NaOH 2СН4
6. Сплавление со щелочью (реакция Дюма)
СН3СООNa + NaOH  CH4 + Na2CO3
7. Разложение карбидов металлов (метанидов) водой:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑
ЦИКЛОАЛКАНЫ
Циклопарафины(циклоалканы) – это предельные углеводороды, содержащие замкнутые циклы из атомов углерода.
Общая формула: СnH2n CH4 + Na2CO3
7. Разложение карбидов металлов (метанидов) водой:
Al4C3 + 12H2O → 4Al(OH)3 + 3CH4↑
ЦИКЛОАЛКАНЫ
Циклопарафины(циклоалканы) – это предельные углеводороды, содержащие замкнутые циклы из атомов углерода.
Общая формула: СnH2n
 Строение: Каждый атом углерода в циклоалканах находится в состоянии sp3 – гибридизации и образует 4 σ-связи ( 2 связи С – С и 2 связи С –Н ). Углы между связями зависят от размера цикла. Устойчивы пяти- и шестичленные циклы, т.к. валентный угол между С –С связями близок к 109о28′. У трех- и четырехчленных циклов вылентный угол меньше, что создает напряженность в циклах, что обуславливает их высокую реакционную способность Строение: Каждый атом углерода в циклоалканах находится в состоянии sp3 – гибридизации и образует 4 σ-связи ( 2 связи С – С и 2 связи С –Н ). Углы между связями зависят от размера цикла. Устойчивы пяти- и шестичленные циклы, т.к. валентный угол между С –С связями близок к 109о28′. У трех- и четырехчленных циклов вылентный угол меньше, что создает напряженность в циклах, что обуславливает их высокую реакционную способность
| Химические свойства:
1. Для 3- и 4- членных циклопарафинов характерны реакции присоединения с разрывом цикла.
а) гидрирования:
б)Циклопропан и его производные присоединяют галогены и галогеноводороды:
2. Для 5- и 6-членных циклопарафинов характерны реакции замещения подобно алканам. а) замещение на галоген
б) Дегидрирование:
| |||||||||||||||||||||||||||||||||||||||||||
Получение
1. Из нефти
2. Действие активных металлов на дигалогензамещенные алканы (реакция Вюрца)
 3.Гидрирование бензола и его гомологов:
3.Гидрирование бензола и его гомологов:
 Б-5-АЛКЕНЫ
Алкены – это непредельные углеводороды, молекулы которых содержат одну двойную связь.
Общая формула: СnH2n
Простейший представитель алкенов – этилен С2Н4, который является родоначальником гомологического ряда.
С2Н4 – этилен СН2=СН2
С3Н6 – пропен СН2=СН – СН3
С4Н8 – бутен СН2=СН – СН2 – СН3
Б-5-АЛКЕНЫ
Алкены – это непредельные углеводороды, молекулы которых содержат одну двойную связь.
Общая формула: СnH2n
Простейший представитель алкенов – этилен С2Н4, который является родоначальником гомологического ряда.
С2Н4 – этилен СН2=СН2
С3Н6 – пропен СН2=СН – СН3
С4Н8 – бутен СН2=СН – СН2 – СН3
  Строение алкенов рассмотрим на примере этилена. Атомы углерода в молекуле этилена находятся в состоянии sp2-гибридизации. По 3 гибридных облака каждого атома углерода располагаются под углом 120о друг к другу и в этих направлениях образуют по 3σ-связи: 1σ-связь друг с другом и 2σ-связи с атомами водорода. Но у каждого атома Строение алкенов рассмотрим на примере этилена. Атомы углерода в молекуле этилена находятся в состоянии sp2-гибридизации. По 3 гибридных облака каждого атома углерода располагаются под углом 120о друг к другу и в этих направлениях образуют по 3σ-связи: 1σ-связь друг с другом и 2σ-связи с атомами водорода. Но у каждого атома
| углерода осталось по одному негибриди-зированному р-облаку. Эти облака
располагаются перпендикулярно плоскости молекулы и перекрываются своими боко-выми частями, образуя дополнительную
связь между атомами
 углерода, которую называют – π-связь.
Таким образом между атомами углерода устанавливается
двойная связь. Длина двойной связи = 0,134 нм, энергия разрыва 620 кДж/моль
Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства:
1. Горят: С2Н4 + 3О2 → 2СО2 + 2Н2О + Q
Так как в молекулах алкенов содержится двойная связь, одна из которых непрочная π-связь и может легко разрываться высвобождая валентности, то для них характерны реакции присоединения.
2. Гидратация:
С2Н4 + Н2О углерода, которую называют – π-связь.
Таким образом между атомами углерода устанавливается
двойная связь. Длина двойной связи = 0,134 нм, энергия разрыва 620 кДж/моль
Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства:
1. Горят: С2Н4 + 3О2 → 2СО2 + 2Н2О + Q
Так как в молекулах алкенов содержится двойная связь, одна из которых непрочная π-связь и может легко разрываться высвобождая валентности, то для них характерны реакции присоединения.
2. Гидратация:
С2Н4 + Н2О  С2Н5ОН (этанол)
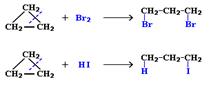
3. Галогенирование:
С2Н4 + Br2 С2Н5ОН (этанол)
3. Галогенирование:
С2Н4 + Br2  C2H4Br2 (качественная реак-ция – обесцвечивание бромной воды).
4. Гидрогалогенирование:
C2H4 + HCl C2H4Br2 (качественная реак-ция – обесцвечивание бромной воды).
4. Гидрогалогенирование:
C2H4 + HCl  C2H5Cl (хлорэтан) C2H5Cl (хлорэтан)
 Направление реакций гидратации и гидрогалогенирования определяется правилом Марковникова:При реакциях присоединения в алкенах по месту двойной связи водород присоединяется к тому ат.С,при котором больше водорода, а ОН и Hal идут к тому ат. С, при котором меньше водорода: Направление реакций гидратации и гидрогалогенирования определяется правилом Марковникова:При реакциях присоединения в алкенах по месту двойной связи водород присоединяется к тому ат.С,при котором больше водорода, а ОН и Hal идут к тому ат. С, при котором меньше водорода:
  СH2=CH-CH3+HCl СH2=CH-CH3+HCl  CH3-CHCl-CH3 CH3-CHCl-CH3
| 5. Гидрирование: С2Н4 + Н2  С2Н6
этан
6. Полимеризация:
nCH2=CH2 С2Н6
этан
6. Полимеризация:
nCH2=CH2  (-CH2-CH2-)n
7. Окисление:
С2Н4 (-CH2-CH2-)n
7. Окисление:
С2Н4  HO-CH2-CH2-OH (качеств.р-я-обесцвечивание р-ра KMnO4)
8. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
9. частичное окисление алкенов с HO-CH2-CH2-OH (качеств.р-я-обесцвечивание р-ра KMnO4)
8. При жестком окислении алкенов кипящим раствором KMnO4 в кислой среде происходит полный разрыв двойной связи:
9. частичное окисление алкенов с 
 образованием циклических оксидов
10. Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
а) приводит или к перемещению p–связи: образованием циклических оксидов
10. Алкены вступают в реакцию изомеризации при нагревании в присутствии катализаторов (Al2O3).
а) приводит или к перемещению p–связи:
 б) или к перестройке углеродного скелета:
б) или к перестройке углеродного скелета:
 Получение
1.Крекинг алканов:
С7Н16 → СН3 – СН=СН2 + С4Н10
2. Дегидрирование алканов
С2Н6
Получение
1.Крекинг алканов:
С7Н16 → СН3 – СН=СН2 + С4Н10
2. Дегидрирование алканов
С2Н6 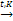 С2Н4 + Н2 ↑
3. Дегидратация спиртов
С2Н5ОН С2Н4 + Н2 ↑
3. Дегидратация спиртов
С2Н5ОН 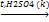 С2Н4 + Н2О
4. Гидрирование алкинов
С2Н2 + Н2 С2Н4 + Н2О
4. Гидрирование алкинов
С2Н2 + Н2  С2Н4
5. Действием спиртового раствора щелочи на галогеналканы. С2Н4
5. Действием спиртового раствора щелочи на галогеналканы.
|  Правило Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода. Правило Зайцева:
Отщепление атома водорода в реакциях дегалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
 6. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
6. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :
 Б-7-АЛКАДИЕНЫ
Диеновые углеводороды(алкадиены) – непредельные углеводороды, молекулы которых содержат две двойных связи.
Общая формула алкадиенов: СnH2n-2
Представители:
С3Н4 – пропадиен СН2=С = СН2
С4Н6 – бутадиен СН2=С = СН – СН3
С5Н8 – пентадиен СН2=С = СН – СН2-СН3
Б-7-АЛКАДИЕНЫ
Диеновые углеводороды(алкадиены) – непредельные углеводороды, молекулы которых содержат две двойных связи.
Общая формула алкадиенов: СnH2n-2
Представители:
С3Н4 – пропадиен СН2=С = СН2
С4Н6 – бутадиен СН2=С = СН – СН3
С5Н8 – пентадиен СН2=С = СН – СН2-СН3
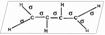 Строение диеновых углеводородов рассмотрим на примере бутадиена-1,3. атомы углерода в его молекуле находятся в состоянии sp2-гибридизации. Гибридные облака атомов
углерода располагаются под углом 1200 Строение диеновых углеводородов рассмотрим на примере бутадиена-1,3. атомы углерода в его молекуле находятся в состоянии sp2-гибридизации. Гибридные облака атомов
углерода располагаются под углом 1200
 и лежат в одной плоскости. В этих направлениях они образуют по 3 σ-связи с другими атомами. Но у каждого атома углерода осталось по одному негибридизи-рованному p-облаку, которые располага-ются перпендикулярно плоскости молекулы и перекрываясь своими боковыми частями образуют 2 π-связи между атомами углерода. и лежат в одной плоскости. В этих направлениях они образуют по 3 σ-связи с другими атомами. Но у каждого атома углерода осталось по одному негибридизи-рованному p-облаку, которые располага-ются перпендикулярно плоскости молекулы и перекрываясь своими боковыми частями образуют 2 π-связи между атомами углерода.
| |||||||||||||||||||||||||||||||||||||||||||
Двойные связи в молекуле могут располагаться по разному:
а) Примыкающие (двойные связи расположены друг за другом)
СН2= С = СН – СН2 - бутадиен – 1,2
б) Сопряженные (двойные связи разделены только одной одинарной связью)
СН2= СН – СН= СН2 - бутадиен – 1,3 (дивинил)
в) Изолированные (двойные связи разделены двумя или более одинарными связями)
СН2= СН - СН2 – СН = СН2 - пентадиен-1,4
По химическим свойствам алкадиены сходны с алкенами, но более активны.
Однако сопряженные диены отличаются некоторыми особенностями.
1. Гидрирование
При гидрировании бутадиена-1,3 получается бутен-2, т.е. происходит 1,4-присоединение. При этом двойные связи разрываются, к крайним атомам углерода С1 и С4 присоединяются атомы водорода, а свободные валентности образуют двойную связь между атомами С2 и С3
 В присутствии катализатора Ni получается продукт полного гидрирования:
В присутствии катализатора Ni получается продукт полного гидрирования:
 2. Галогенирование. (качеств.р-я – обесцве-чивание бромной воды.
1,4-присоединение:
2. Галогенирование. (качеств.р-я – обесцве-чивание бромной воды.
1,4-присоединение:
 1,2-присоединение:
1,2-присоединение:
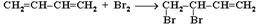 При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
3. Легко полимеризуются
При избытке брома присоединяется еще одна его молекула по месту оставшейся двойной связи с образованием 1,2,3,4-тетрабромбутана.
3. Легко полимеризуются
| 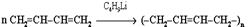 бутадиеновый каучук
4. Присоединение галогеноводородов
1,4-присоединение
СН2=СН-СН=СН2 +HCl →СН3-СН=СН-СН2Cl
1,2-присоединение
бутадиеновый каучук
4. Присоединение галогеноводородов
1,4-присоединение
СН2=СН-СН=СН2 +HCl →СН3-СН=СН-СН2Cl
1,2-присоединение
 СН2=СН-СН=СН2 +HCl → СН3-СН-СН=СН2
Cl
5. Горят
2С4Н6 + 11О2 → 8СО2 + 6Н2О + Q
Получение
1. Из этанола при одновременной дегидратации и дегидрировании:
2С2Н5ОН СН2=СН-СН=СН2 +HCl → СН3-СН-СН=СН2
Cl
5. Горят
2С4Н6 + 11О2 → 8СО2 + 6Н2О + Q
Получение
1. Из этанола при одновременной дегидратации и дегидрировании:
2С2Н5ОН 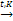 СН2=СН-СН=СН2 + Н2О+Н2↑
2. Дегидрирование алкенов
С4Н8 СН2=СН-СН=СН2 + Н2О+Н2↑
2. Дегидрирование алкенов
С4Н8 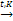 СН2=СН-СН=СН2 + Н2↑
3. Дегидрирование алканов
С4Н10 СН2=СН-СН=СН2 + Н2↑
3. Дегидрирование алканов
С4Н10  СН2=СН-СН=СН2 + 2Н2↑ СН2=СН-СН=СН2 + 2Н2↑
 4. Действие спиртового раствора щелочи на дигалогеналканы:
5. Дегидратация гликолей (двухатомных спиртов, или алкандиолов): 4. Действие спиртового раствора щелочи на дигалогеналканы:
5. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
 Б-8-АЛКИНЫ
Непредельные углеводороды, молекулы которых содержат одну тройную связь называются алкинами.
Общая формула алкинов: СnH2n-2
Гомологический ряд
Б-8-АЛКИНЫ
Непредельные углеводороды, молекулы которых содержат одну тройную связь называются алкинами.
Общая формула алкинов: СnH2n-2
Гомологический ряд
Строение С2Н2 В молекуле ацетилена атомы углерода находятся в состоянии sр-гибридизации. Гибридные облака атомов углерода, | стремясь удалиться
как можно дальше друг от друга, располагают-ся под  180о и в этих
направлениях образуют по 2 σ-связи с другими атомами (1 σ-связь с сосед-
ним атомом углерода и 1 σ-связь с атомом водорода). Поэтому молекула ацетилена имеет линейное строение. Негибридизи рованные р-облака, по одному от каждого
атома углерода, располагаются во взаимно 180о и в этих
направлениях образуют по 2 σ-связи с другими атомами (1 σ-связь с сосед-
ним атомом углерода и 1 σ-связь с атомом водорода). Поэтому молекула ацетилена имеет линейное строение. Негибридизи рованные р-облака, по одному от каждого
атома углерода, располагаются во взаимно
   перпендикулярных плоскостях и при боковом перекрытии образуют 2 π- связи между атомами
углерода.
Длина С ≡ С-связи = 0,12нм
Химические свойства:
1. Горит коптящим пламенем:
2С2Н2 + 5О2 → 4СО2 + 2Н2О + Q
Так как в молекуле алкинов 2π-связи, то для них характерны реакции присоединения.
2. Гидрирование: С2Н2 + Н2 перпендикулярных плоскостях и при боковом перекрытии образуют 2 π- связи между атомами
углерода.
Длина С ≡ С-связи = 0,12нм
Химические свойства:
1. Горит коптящим пламенем:
2С2Н2 + 5О2 → 4СО2 + 2Н2О + Q
Так как в молекуле алкинов 2π-связи, то для них характерны реакции присоединения.
2. Гидрирование: С2Н2 + Н2  С2Н6
этан
3. Галогенирование (обесцвечивание бромной воды – качественная реакция):
СН ≡ СН + Br2 → CHBr – CHBr
1,1,2,2-тетрабромэтан
4. Присоединение галогеноводородов: СН ≡ СН + HCl → CH2 = CHCl - хлорвинил
5. Гидратация (реакция Кучерова) : СН ≡ СН + Н2О С2Н6
этан
3. Галогенирование (обесцвечивание бромной воды – качественная реакция):
СН ≡ СН + Br2 → CHBr – CHBr
1,1,2,2-тетрабромэтан
4. Присоединение галогеноводородов: СН ≡ СН + HCl → CH2 = CHCl - хлорвинил
5. Гидратация (реакция Кучерова) : СН ≡ СН + Н2О  СН3 – СОН
уксусный альдегид
6. Обесцвечивание раствора КMnO4 (качественная реакция)
СН ≡ СН + [O] + Н2О СН3 – СОН
уксусный альдегид
6. Обесцвечивание раствора КMnO4 (качественная реакция)
СН ≡ СН + [O] + Н2О  НООС – СООН
щавелевая кислота
7. Вступает в реакции замещения с оксидами металлов: НООС – СООН
щавелевая кислота
7. Вступает в реакции замещения с оксидами металлов:
| СН ≡ СН + Ag2O  AgC ≡ CAg + Н2О
ацетиленид серебра AgC ≡ CAg + Н2О
ацетиленид серебра
 8. Ацетилен и его гомологи с концевой тройной связью R-С≡≡ СН проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются
СН3- С≡ С-СН3 + Ag2O (Na) ≠
9. Полимеризация ацетилена:
а) тримеризация
3 С2Н2 8. Ацетилен и его гомологи с концевой тройной связью R-С≡≡ СН проявляют слабые кислотные свойства: атомы водорода могут замещаться атомами металла. При этом образуются соли – ацетилениды :
Если тройная связь находится не на конце цепи, то кислотные свойства отсутствуют (нет подвижного атома водорода) и ацетилениды не образуются
СН3- С≡ С-СН3 + Ag2O (Na) ≠
9. Полимеризация ацетилена:
а) тримеризация
3 С2Н2  С6Н6 - бензол
б) димеризация
2С2Н2 С6Н6 - бензол
б) димеризация
2С2Н2  СН2=СН – С ≡ СН-винилацетилен
Получение
1. Действием воды на карбид кальция:
СаС2 + 2 Н2О → Са(ОН)2 + С2Н2↑
2. Неполное термическое разложение метана: 2СН4 СН2=СН – С ≡ СН-винилацетилен
Получение
1. Действием воды на карбид кальция:
СаС2 + 2 Н2О → Са(ОН)2 + С2Н2↑
2. Неполное термическое разложение метана: 2СН4   ↑+ 3Н2↑
3. Дегидрирование алканов:
С2Н6 ↑+ 3Н2↑
3. Дегидрирование алканов:
С2Н6  С2Н2 + 2Н2↑
4. Действием спиртового раствора щелочи на дигалогеналканы.
СН3-СНBr – СНBr –СН3 + 2КОН →
СН3-С ≡ С–СН3 + 2KBr + 2H2O
СН3-СН2 – СНBr 2 –СН3 + 2КОН →
СН3-С ≡ С–СН3 + 2KBr + 2H2O С2Н2 + 2Н2↑
4. Действием спиртового раствора щелочи на дигалогеналканы.
СН3-СНBr – СНBr –СН3 + 2КОН →
СН3-С ≡ С–СН3 + 2KBr + 2H2O
СН3-СН2 – СНBr 2 –СН3 + 2КОН →
СН3-С ≡ С–СН3 + 2KBr + 2H2O
| |||||||||||||||||||||||||||||||||||||||||||
Б-11-АРЕНЫ
Ароматические углеводороды(арены) – соединения, молекулы которых содержат устойчивые циклические структуры – бензольные кольца, с особым характером связи.
Общая формула аренов: СnH2n-6
Строение:
Молекула бензола представляет собой правильный шестиугольник, лежащий в одной плоскости.
 Атомы углерода в молекуле бензола находятся в состоянии sр2-гибридизации. Гибридные облака по 3 от каждого атома углерода располагаются под Атомы углерода в молекуле бензола находятся в состоянии sр2-гибридизации. Гибридные облака по 3 от каждого атома углерода располагаются под  120о друг к другу и в этих направлениях образуют по 3σ-связи с соседними атомами (2σ-связи с атомами углерода и 1σ-связь с атомом водорода).
Негибридизированные р-облака, по одному от каждого атома углерода, располагаются перпендикулярно плоскости кольца. Перекрываясь своими
боковыми частями, р-облака образуют между атомами углерода дополнительно
6 π-связей. р-электроны в молекуле бензола делокализо ваны и образуют единое шести- р-электронное облако. , расположенное в виде двух «бубликов» сверху и снизу бензольного кольца. 120о друг к другу и в этих направлениях образуют по 3σ-связи с соседними атомами (2σ-связи с атомами углерода и 1σ-связь с атомом водорода).
Негибридизированные р-облака, по одному от каждого атома углерода, располагаются перпендикулярно плоскости кольца. Перекрываясь своими
боковыми частями, р-облака образуют между атомами углерода дополнительно
6 π-связей. р-электроны в молекуле бензола делокализо ваны и образуют единое шести- р-электронное облако. , расположенное в виде двух «бубликов» сверху и снизу бензольного кольца.
  Электронная плотность распределяется в молекуле равномерно, все связи между атомами совершенно одинаковы. Электронная плотность распределяется в молекуле равномерно, все связи между атомами совершенно одинаковы.
 Поэтому структурная формула бензола: Поэтому структурная формула бензола:
  СН СН
  НС СН или
НС СН
СН НС СН или
НС СН
СН
| В молекуле бензола ароматическая связь – полуторная, т.е. промежуточная между σ-
и π-связью.
Химические свойства:
1. Горит коптящим пламенем:
2С6Н6 + 15О2 → 12СО2 + 6Н2О
 Так как в молекуле бензола связь промежуточная между σ- и π-связью, то он будет проявлять свойства предельных и непредельных углеводородов.
2. Реакции замещения:
а) галогенирование (но бромную воду не обесцвечивает).
С6Н6 + Br2 Так как в молекуле бензола связь промежуточная между σ- и π-связью, то он будет проявлять свойства предельных и непредельных углеводородов.
2. Реакции замещения:
а) галогенирование (но бромную воду не обесцвечивает).
С6Н6 + Br2  С6Н5Br +HBr
б) нитрование:
С6Н6 + HNO3 С6Н5Br +HBr
б) нитрование:
С6Н6 + HNO3  С6Н5NO2 + H2O
Нитробензол С6Н5NO2 + H2O
Нитробензол
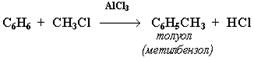 в) алкилирование -замещение водорода на у/в радикал
В:Бензол вступает в р-ии замещения как предельные у/в, но они у него протекают легче.
3. Реакции присоединения. а) гидрирование
С6Н6 + 3Н2 в) алкилирование -замещение водорода на у/в радикал
В:Бензол вступает в р-ии замещения как предельные у/в, но они у него протекают легче.
3. Реакции присоединения. а) гидрирование
С6Н6 + 3Н2  С6Н12 (циклогексан)
б) галогенирование на свету:
С6Н6 + 3Cl2 С6Н12 (циклогексан)
б) галогенирование на свету:
С6Н6 + 3Cl2  С6Н6Cl6
Гексахлорциклогексан
Получение: 1. Выделяют из нефти, каменного угля.
2. Дегидрирование циклопарафинов:
С6Н12 С6Н6Cl6
Гексахлорциклогексан
Получение: 1. Выделяют из нефти, каменного угля.
2. Дегидрирование циклопарафинов:
С6Н12  С6Н6 + 3Н2↑
3. Дегидрирование и циклизация алканов:
С6Н14 С6Н6 + 3Н2↑
3. Дегидрирование и циклизация алканов:
С6Н14  С6Н6 + 4Н2↑
4. Тримеризация ацетилена: С6Н6 + 4Н2↑
4. Тримеризация ацетилена:
| 3 С2Н2  С6Н6
ГОМОЛОГИ БЕНЗОЛА
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими или положение заместителей указывают перед тривиальным названием соединения приставками:
орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-;
мета- (м-) заместители через один атом углерода (1,3-);
пара- (п-) заместители на противоположных сторонах кольца (1,4-) С6Н6
ГОМОЛОГИ БЕНЗОЛА
Гомологи бензола – соединения, образованные заменой одного или нескольких атомов водорода в молекуле бензола на углеводородные радикалы (R):
Если радикалов два или более, их положение указывается номерами атомов углерода в кольце, с которыми они связаны. Нумерацию кольца проводят так, чтобы номера радикалов были наименьшими или положение заместителей указывают перед тривиальным названием соединения приставками:
орто- (о-) заместители у соседних атомов углерода кольца, т.е. 1,2-;
мета- (м-) заместители через один атом углерода (1,3-);
пара- (п-) заместители на противоположных сторонах кольца (1,4-)
 Ароматические одновалентные радикалы имеют общее название "арил".
Из них наиболее распространены два: C6H5- (фенил) и C6H5CH2- (бензил).
Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (вызывает заболевание крови – лейкемию).
Ароматические одновалентные радикалы имеют общее название "арил".
Из них наиболее распространены два: C6H5- (фенил) и C6H5CH2- (бензил).
Физические свойства. Бензол и его ближайшие гомологи – бесцветные жидкие вещества, нерастворимые в воде, но хорошо растворяющиеся во многих органических жидкостях. Легче воды. Огнеопасны. Бензол токсичен (вызывает заболевание крови – лейкемию).
| Химические свойства
Сходства с бензолом 1. Гидрирование
СН3–С6Н5 + 3Н2  СН3–С6Н11
Метилциклогексан
Различия с бензолом Метильная группа СH3
повышает электронную плотность в бензольном кольце в положениях 2, 4, 6 СН3–С6Н11
Метилциклогексан
Различия с бензолом Метильная группа СH3
повышает электронную плотность в бензольном кольце в положениях 2, 4, 6
 1. При нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водоро -да с образованием 2,4,6-тринитротолуола: 1. При нитровании толуола С6Н5CH3 (70°С) происходит замещение не одного, а трех атомов водоро -да с образованием 2,4,6-тринитротолуола:
 2. При бромировании толуола также замещаются три атома водорода:
СН3–С6Н5 + 3Br2
2. При бромировании толуола также замещаются три атома водорода:
СН3–С6Н5 + 3Br2  СН3–С6Н2Br3 + 3HBr
Под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения.
3. Толуол окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
С6Н5– СН3 +3[O] → С6Н5 – COOH + H2O
4. реакция замещения в радикале на галоген СН3–С6Н2Br3 + 3HBr
Под влиянием бензольного кольца метильная группа СH3 в толуоле становится более активной в реакциях окисления и радикального замещения.
3. Толуол окисляется в мягких условиях (обесцвечивает подкисленный раствор KMnO4 при нагревании):
С6Н5– СН3 +3[O] → С6Н5 – COOH + H2O
4. реакция замещения в радикале на галоген
 Получение 1.Дегидрирование циклоалканов
СН3–С6Н11
Получение 1.Дегидрирование циклоалканов
СН3–С6Н11  СН3–С6Н5 + 3Н2
2. Алкилирование бензола галогеналканами СН3–С6Н5 + 3Н2
2. Алкилирование бензола галогеналканами

|
 ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ.
ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. КИСЛОРОДСОДЕРЖАЩИЕ СОЕДИНЕНИЯ.
Б-10-ОДНОАТОМНЫЕ СПИРТЫ
Спирты(алкоголи) – производные углеводородов, в молекулах которых один или несколько атомов водорода замещены гидроксильными группами.
Общая формула: СnH2n+1OH
Простейшие представители: СН3-ОН - метанол
С2Н5-ОН - этанол
С3Н7-ОН - пропанол
Строение спиртов рассмотрим на примере этилового спирта - С2Н5-ОН
СН3 – СН2 – Оσ-←Нσ+ Связи С – С и С – Н – это ковалентные σ-связи. Кислород образует такие же связи с
атомами углерода и водорода. Однако распределение электронной плотности в
молекуле спирта не равномерно. Связь О – Н
полярна, т.к. наибольшая электронная плотность ее смещена к атому кислорода, как к более ЭОэлементу. Атом водорода оказывается как бы более свободным от электронов, менее связанным с молекулой и поэтому может отщепляться.
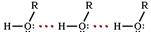 Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей. Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения. Следствием полярности связи О–Н и наличия неподеленных пар электронов на атоме кислорода является способность гидроксисоединений к образованию водородных связей. Это объясняет, почему даже низшие спирты - жидкости с относительно высокой температурой кипения.
| Физические свойства.С1 – С12 – жидкости, С13 – С20- мазеобразные, С21и т.д. –твердые. С1-С3- хорошо растворимы, имеют алкогольный запах; С4-С5 –плохо растворимы, сладковатый, удушливый запах. С6- С11 –нерастворимы, неприятный запах. Твердые –без запаха, нерастворимы Все спирты легче воды.
Химические свойства
1. Горение:
С2Н5ОН + 3О2  2СО2 + 3Н2О
2. Взаимодействуют со щелочными Ме, проявляя кислотные свойства:
2 С2Н5-ОН + 2Na → 2 С2Н5-ОNa + Н2↑
этилат натрия 2СО2 + 3Н2О
2. Взаимодействуют со щелочными Ме, проявляя кислотные свойства:
2 С2Н5-ОН + 2Na → 2 С2Н5-ОNa + Н2↑
этилат натрия
 С возрастанием радикала активность спиртов по отношению к щелочным Ме падает С возрастанием радикала активность спиртов по отношению к щелочным Ме падает
 С2Н5→Оσ-←Нσ+ Чем больше радикал, тем
С4Н9→Оσ-← Нσ+ большую электронную плотность он подает на кислород, тем больший σ- он приобретает С2Н5→Оσ-←Нσ+ Чем больше радикал, тем
С4Н9→Оσ-← Нσ+ большую электронную плотность он подает на кислород, тем больший σ- он приобретает  прочнее удерживает атом водорода прочнее удерживает атом водорода  водород теряет подвижность, а спирт активность.
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный.
3. Взаимодействуют с галогеноводородами:
С2Н5-ОН + НСl → С2Н5Сl + Н2О
хлорэтан
4. Подвергаются дегидратации:
а) внутримолекулярная:
С2Н5-ОН водород теряет подвижность, а спирт активность.
Кислотность одноатомных спиртов убывает в ряду:
CH3OH > первичный > вторичный > третичный.
3. Взаимодействуют с галогеноводородами:
С2Н5-ОН + НСl → С2Н5Сl + Н2О
хлорэтан
4. Подвергаются дегидратации:
а) внутримолекулярная:
С2Н5-ОН   + Н2О
б) межмолекулярная:
2С2Н5-ОН + Н2О
б) межмолекулярная:
2С2Н5-ОН  С2Н5-О-С2Н5 + Н2О
диэтиловый эфир
5. Дают реакцию этерификации с карбоновыми кислотами. С2Н5-О-С2Н5 + Н2О
диэтиловый эфир
5. Дают реакцию этерификации с карбоновыми кислотами.
| СН3-СООН + НО-С2Н5  СН3-СО-О-С2Н5 + Н2О этилацетат
6. Окисляются образуя альдегиды (качественная р-я):
С2Н5-ОН + СuО СН3-СО-О-С2Н5 + Н2О этилацетат
6. Окисляются образуя альдегиды (качественная р-я):
С2Н5-ОН + СuО  СН3-СОН + Cu + Н2О
уксусный альдегид
Легкость окисления спиртов уменьшается в ряду: первичные > вторичные > третичные.
При окислении вторичных спиртов образуются кетоны.
СН3-СH-СН3 + [O] → СН3-С-СН3 + H2O
׀ ׀׀ ацетон
OH O
7. Подвергаются одновременной дегидратации и дегидрированию:
2С2Н5-ОН СН3-СОН + Cu + Н2О
уксусный альдегид
Легкость окисления спиртов уменьшается в ряду: первичные > вторичные > третичные.
При окислении вторичных спиртов образуются кетоны.
СН3-СH-СН3 + [O] → СН3-С-СН3 + H2O
׀ ׀׀ ацетон
OH O
7. Подвергаются одновременной дегидратации и дегидрированию:
2С2Н5-ОН  С4Н6 + 2Н2О + Н2↑
Получение:
1. Гидратация этилена:
СН2=СН2 + Н2О С4Н6 + 2Н2О + Н2↑
Получение:
1. Гидратация этилена:
СН2=СН2 + Н2О  С2Н5ОН
2. Восстановление альдегидов:
СН3-СОН + Н2 С2Н5ОН
2. Восстановление альдегидов:
СН3-СОН + Н2  С2Н5-ОН
3. Спиртовое брожение глюкозы:
С6Н12О6 С2Н5-ОН
3. Спиртовое брожение глюкозы:
С6Н12О6  2С2Н5-ОН + 2 СО2↑
4. Щелочной гидролиз галогеналканов: С2Н5Br + NaOH(р-р) → С2Н5-ОН + NaBr
Б-12-МНОГОАТОМНЫЕ СПИРТЫ
-органические вещества, молекулы которых содержат гидроксильных групп, соединенных с углеводородным радикалом.
этиленгликоль (этандиол 1,2)
HO–СH2–CH2–OH
глицерин (пропантриол-1,2,3) 2С2Н5-ОН + 2 СО2↑
4. Щелочной гидролиз галогеналканов: С2Н5Br + NaOH(р-р) → С2Н5-ОН + NaBr
Б-12-МНОГОАТОМНЫЕ СПИРТЫ
-органические вещества, молекулы которых содержат гидроксильных групп, соединенных с углеводородным радикалом.
этиленгликоль (этандиол 1,2)
HO–СH2–CH2–OH
глицерин (пропантриол-1,2,3)
   СН2-СН-СН2 ОН ОН ОН
Не являются членами одного СН2-СН-СН2 ОН ОН ОН
Не являются членами одного
| гомологического ряда
Химические свойства
Сходства с одноатомными спиртами.
1.Горят: 2С2Н4(ОН)2 + 5О2 → 4СО2 + 6Н2О
2. Взаимодействуют со щелочными Ме:
  СН2 – ОН + 2Na → СН2 – ОNa + H2
СН2 – ОН СН2 – ОNa
2. Образуют сложные эфиры с кислотами СН2 – ОН + 2Na → СН2 – ОNa + H2
СН2 – ОН СН2 – ОNa
2. Образуют сложные эфиры с кислотами
  СН2 – ОН СН2 – О – NO2 СН2 – ОН СН2 – О – NO2
  СН – ОН +3НОNO2→СН – О – NO2+3H2O
СН2 – ОН СН2 – О – NO2
Тринитроглицерин (динамит)
3. Взаимодействуют с галогеноводородами: СН – ОН +3НОNO2→СН – О – NO2+3H2O
СН2 – ОН СН2 – О – NO2
Тринитроглицерин (динамит)
3. Взаимодействуют с галогеноводородами:
  СН2 – ОН + 2HCl → СН2 – Cl + 2H2O
СН2 – ОН СН2 – Cl
1,2-дихлорэтан СН2 – ОН + 2HCl → СН2 – Cl + 2H2O
СН2 – ОН СН2 – Cl
1,2-дихлорэтан
  СН2 – ОН + HCl → СН2 – ОН + H2O
СН2 – ОН СН2 – Cl
2-хлорэтанол
4. Подвергаются дегидратации:
а) внутримолекулярная: СН2 – ОН + HCl → СН2 – ОН + H2O
СН2 – ОН СН2 – Cl
2-хлорэтанол
4. Подвергаются дегидратации:
а) внутримолекулярная:
 СН2 – ОН СН2 – ОН  CН3 – СОН + H2O
СН2 – ОН уксусный альдегид
б) межмолекулярная: CН3 – СОН + H2O
СН2 – ОН уксусный альдегид
б) межмолекулярная:
    СН2 – ОН + НО – СН2 СН2 – ОН + НО – СН2  СН2 – О – СН2
СН2 – ОН НО – СН2 СН2 – О – СН2
+ 2 H2O диоксан
Отличительные свойства
1. Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов: СН2 – О – СН2
СН2 – ОН НО – СН2 СН2 – О – СН2
+ 2 H2O диоксан
Отличительные свойства
1. Многоатомные спирты с ОН-группами у соседних атомов углерода (этиленгликоль, глицерин и т.п.) являются более сильными кислотами, чем одноатомные спирты. Они образуют соли не только в реакциях с активными металлами, но и под действием их гидроксидов:
  СН2 – ОН + 2NaОН → СН2 – ОNa + 2H2О
СН2 – ОН СН2 – ОNa
2. Качественная р-я: взаимодействуют с Cu(OH)2,образуя ярко-синие растворы: СН2 – ОН + 2NaОН → СН2 – ОNa + 2H2О
СН2 – ОН СН2 – ОNa
2. Качественная р-я: взаимодействуют с Cu(OH)2,образуя ярко-синие растворы:
   СН2 – ОН СН2 – О – Сu СН2 – ОН СН2 – О – Сu
  СН – ОН + Cu(OH)2→СН – О +2H2O
СН2 – ОН СН2 – ОН СН – ОН + Cu(OH)2→СН – О +2H2O
СН2 – ОН СН2 – ОН
| |
  3. Окисление КMnO4
3C3H5(OH)3+ 14 КMnO4 →14KOH+ 14MnO2 + 9CO2 + 5H2O
Получение:
1. Щелочной гидролиз галогеналканов:
С3Н5Сl3 + 3NaOH(р-р) → С3Н5-(ОН)3 +3NaCl
2. Окисление алкенов раствором KMnO4 3. Окисление КMnO4
3C3H5(OH)3+ 14 КMnO4 →14KOH+ 14MnO2 + 9CO2 + 5H2O
Получение:
1. Щелочной гидролиз галогеналканов:
С3Н5Сl3 + 3NaOH(р-р) → С3Н5-(ОН)3 +3NaCl
2. Окисление алкенов раствором KMnO4

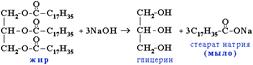 3. Гидролиз жиров
Б-13-ФЕНОЛ
Фенолы – гидроксильные производные ароматических углеводородов, в молекулах которых гидроксогруппа связана с бензольным ядром.
Простейший представитель:
ОН С6Н5ОН – фенол (карболовая 3. Гидролиз жиров
Б-13-ФЕНОЛ
Фенолы – гидроксильные производные ароматических углеводородов, в молекулах которых гидроксогруппа связана с бензольным ядром.
Простейший представитель:
ОН С6Н5ОН – фенол (карболовая
 | кислота) | кислота)
 Физические свойства:
Фенол – бесцветное кристалли- ческое вещество с характерным запахом (окисляясь на воздухе становится розовым). Легкоплавкий, tпл= 42оС. Малорастворим в воде, сильный антисептик. Ядовит! Физические свойства:
Фенол – бесцветное кристалли- ческое вещество с характерным запахом (окисляясь на воздухе становится розовым). Легкоплавкий, tпл= 42оС. Малорастворим в воде, сильный антисептик. Ядовит!
  Строение фенола: Одна из неподеленных электронных пар атома кислорода втягивается в π- электронную систему бензольного кольца. При этом происходит перераспре деление электронной плотности, она сгущается у 2,4,6 атомов углерода. Атомы водорода в этих положе -ниях становятся более подвижными и легко замещаются на другие атомы.
Электронная плотность на атоме кислорода уменьшается и он начинает сильнее Строение фенола: Одна из неподеленных электронных пар атома кислорода втягивается в π- электронную систему бензольного кольца. При этом происходит перераспре деление электронной плотности, она сгущается у 2,4,6 атомов углерода. Атомы водорода в этих положе -ниях становятся более подвижными и легко замещаются на другие атомы.
Электронная плотность на атоме кислорода уменьшается и он начинает сильнее
| смещать на себя электронную плотность связи О – Н. Атом водорода становится более подвижным и реакционноспособным.
Физические свойства:
Фенол – бесцветное кристаллическое вещество с характерным запахом (окисляясь на воздухе становится розовым). Легкоплавкий, tпл= 42оС. Малорастворим в воде, сильный антисептик. Ядовит!
Химические свойства:
1. Взаимодействует со щелочными Ме:
2С6Н5ОН + 2Na → 2С6Н5ОNa + Н2↑
фенолят натрия
2.Взаимодействует со щелочами:
С6Н5ОН + NaОН → С6Н5ОNa + Н2О
3. Обесцвечивает бромную воду(образуется белый осадок):
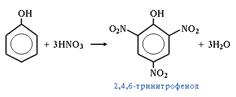
 4. Легко нитруется:
4. Легко нитруется:
 5. Качественная реакция на фенол.
Реактивом на фенол является хлорид железа (III) – образуется фенолят железа – фиолетового цвета. 3С6Н5ОН + FeCl3 → (С6Н5О)3Fe + 3HCl
Получение:
1. Выделяют из каменно-угольной смолы.
2. Из галогенбензолов:
С6Н5Сl + NaOH → С6Н5ОН + NaCl
5. Качественная реакция на фенол.
Реактивом на фенол является хлорид железа (III) – образуется фенолят железа – фиолетового цвета. 3С6Н5ОН + FeCl3 → (С6Н5О)3Fe + 3HCl
Получение:
1. Выделяют из каменно-угольной смолы.
2. Из галогенбензолов:
С6Н5Сl + NaOH → С6Н5ОН + NaCl
| Б-14-АЛЬДЕГИДЫ
- органические вещества, молекулы которых содержат функциональную группу – карбонил –СОН
Общая формула СnH2n+1COH
Гомологический ряд:
НСОН метаналь (муравьиный альдегид)
СН3СОН этаналь (уксусный альдегид)
С2Н5СОН пропаналь
Cтроение:
Атом углерода карбонильной группы находится в состоянии sр2-гибридиза-
ции и образует 3σ-связи, которые распола гаются в одной плоскости под углом 120о
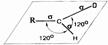 друг к другу. По одному негиб- ридизированному р-облаку атомов углерода и кислорода, перекрываясь своими боковыми частями над и плоскостью ммолекулы, друг к другу. По одному негиб- ридизированному р-облаку атомов углерода и кислорода, перекрываясь своими боковыми частями над и плоскостью ммолекулы,
  под образуют π-связь. Двойная связь С=О является сочета нием одной σ-связи и одной π-связи. В силу большей электроотрицательности
атома кислорода, электронная плотность двойной связи смещена в его сторону.
В результате чего атом кислорода
получает частичный отрицательный заряд, а углерод – частичный положительный заряд.
Таким образом карбонильная группа сильно
поляризована, что обуславливает
высокую реакционную способность альдегидов. Атом кислорода оказывает влияние на атом водорода, соединенный с карбонильной группой, вследствие чего он становится более подвижным и легко окисляется.
Химические свойства:
Для альдегидов характерны 2 типа реакций: присоединения по месту двойной связи, окисления – по месту водорода карбонила. под образуют π-связь. Двойная связь С=О является сочета нием одной σ-связи и одной π-связи. В силу большей электроотрицательности
атома кислорода, электронная плотность двойной связи смещена в его сторону.
В результате чего атом кислорода
получает частичный отрицательный заряд, а углерод – частичный положительный заряд.
Таким образом карбонильная группа сильно
поляризована, что обуславливает
высокую реакционную способность альдегидов. Атом кислорода оказывает влияние на атом водорода, соединенный с карбонильной группой, вследствие чего он становится более подвижным и легко окисляется.
Химические свойства:
Для альдегидов характерны 2 типа реакций: присоединения по месту двойной связи, окисления – по месту водорода карбонила.
| 1. Реакции присоединения
а) альдегиды восстанавливаются водородом до спиртов.
| |
|
из
5.00
|
Обсуждение в статье: ОСНОВНЫЕ КЛАССЫ ОРГАНИЧЕСКИХ СОЕДИНЕНИЙ. УГЛЕВОДОРОДЫ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |
Популярное:
Как распознать напряжение: Говоря о мышечном напряжении, мы в первую очередь имеем в виду мускулы, прикрепленные к костям ...
Почему двоичная система счисления так распространена?: Каждая цифра должна быть как-то представлена на физическом носителе...
Как вы ведете себя при стрессе?: Вы можете самостоятельно управлять стрессом! Каждый из нас имеет право и возможность уменьшить его воздействие на нас...
Почему человек чувствует себя несчастным?: Для начала определим, что такое несчастье. Несчастьем мы будем считать психологическое состояние...

©2015-2024 megaobuchalka.ru Все материалы представленные на сайте исключительно с целью ознакомления читателями и не преследуют коммерческих целей или нарушение авторских прав. (1120)
Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


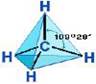
 Строение алканов рассмотрим на примере метана. Молекула метана в пространстве имеет форму тетраэдра.
Атом углерода в молекулах алканов находится
Строение алканов рассмотрим на примере метана. Молекула метана в пространстве имеет форму тетраэдра.
Атом углерода в молекулах алканов находится  в состоянии sp3-гибридизации. Все 4 гибридных облака направлены большей частью к вершинам тетраэдра под углом 109028′ друг к другу. В этих направлениях атом углерода образует
в состоянии sp3-гибридизации. Все 4 гибридных облака направлены большей частью к вершинам тетраэдра под углом 109028′ друг к другу. В этих направлениях атом углерода образует