 |
Главная |
Определение времени обеэгаживания
|
из
5.00
|
Расчетное время обезгаживания tобр, необходимое для удаления газов, сортированных и растворенных в материалах обращенных в вакуум реципиента уже было введено нами в формулу 2. Для поддержания потока газовыделения Q на максимально допустимом уровне (для ускорения процесса) нам нужно иметь практически безинерционную систему автоматического регулирования нагрева внутривакуумной арматуры и корпуса реципиента. Реальные реципиенты: - электровакуумные приборы, особенно крупногабаритные - такие как ЦЭЛТ, а также технологические вакуумные камеры обладают большой инерционностью нагрева и охлаждения. Кроме того, для стеклянных ЗВП, вследствие неравномерности нагрева, вызывающего заметные температурные градиенты, скорость нагрева ограничена растрескиванием изделий из-за возникновения внутренних напряжений.
Так, допустимая скорость нагрева ЭВП из стекла С93-1 составляет VH=0,14 град/с, охлаждения Vox=0,10 град/с, (при температуре обезгаживания TОБ=300-400° С).
Тогда время нагрева изделия до температуры обеэгаживания.
tН=(Tоб-20)/VH, с (21)
Время охлаждения:
tОХ=(Tоб-20)/VОХ, с (22)
Для цельнометаллических реципиентов скорости нагрева и охлаждения могут быть резко (на порядок) увеличены. Технически это достигается использованием галогенных ламп. В то же время скорость охлаждения внутренней арматуры ограничена низкой теплопроводностью остаточных газов (теплопроводностью вакуума) и часто определяется только тепловой радиацией.
После обезгаживания арматуры в соответствии с технологической диаграммой проводится обезгаживание катода или испарителя, проводимое при более высоких температурах (700 - 1000° С) и давлениях Робк (Робк=(3-10)Роб) и определяется особенностями техпроцесса:
 (23)
(23)
где mк - масса нагреваемых деталей катода (испарителя и материала); gк - газосодержание деталей катода (испарителя и материала).
(Для оксидных катодов газовыделение определяется скоростью разложения карбонатов)..
Суммарное время обеэгаживания реципиента составит
tоб=tобр+tН+tох+tобк (24)
После обезгаживания катода в ЭВП (или испарителя электронного, ионного источника в технологической установке) давление в реципиенте падает от величины Робк до величины Рк (окончательного давления) за время tк, которое рассматривается по Формуле 20 в которой принимается P1=Pобк, Р2=Рк. После достижения в ЭВП давления РК начинается отпай прибора, а в технологической элионной установке - техпроцесс обработки изделия.
Следует отметить, что подобный расчет процесса, когда давление при обезгаживании принимается постоянным является упрощенным.
Давление при обезгаживании системы может поддерживаться постоянным с помощью системы автоматического регулирования температур, которая автоматически увеличивается по мере уменьшения потока газовыделения с поверхностей обращенных в вакуум. Но надо помнить, что подобные системы не обеспечивают строго постоянного давления, а поддерживают его в заданных границах, выход на режим обезгаживания представляет сложный переходный процесс.
Обычно вакуумные системы обезгаживают при постоянной температуре, Тоб. Выход на эту температуру происходит за время tнагр (см. раздел) обеспечивающее сохранность (нерастрескивание) стеклянных и керамических деталей.
Расчет времени откачки с учетом процесса обезгаживания даст результаты близкие к реально достигаемым на практике цифрам, которые резко отличатся от расчета идеально обезгаженной системы.
Ниже на двух примерах рассмотрим аналитический и графический методы расчета времени откачки с учетом газовыделения стенок камеры при постоянной температуре. Оба расчета дают время откачки начиная с давления Ро при котором газовыделение со стенок начинает влиять на процесс откачки
Для проведения расчетов напомним основы физической адсорбции.
2.13 Расчет времени откачки с учетом процессов сорбции- десорбции
При рассмотрении физической адсорбции количество поглощенного газа обычно относят к единице поверхности твердого тела. Если вакантные места заняты молекулами, то говорят, что заполнение поверхности твердого тела равно одному монослою. Заполнение поверхности адсорбированным газом можно характеризовать коэффициентом покрытия  .
.
 ; (1)
; (1)
где Nпов – количество молекул, адсорбированных на границе поверхности твердого тела; N1пов – число мест на единице поверхности, которые могут быть заняты адсорбированными молекулами (число молекул в заполненном мономолекулярном слое). Число молекул N1пов рассчитывают, полагая что молекулы газа покрывают поверхность тела с шагом, равным их диаметру  (см. приложение 1). При этом получаются значения от 0,4*1019 до 2,5*1019 м-2 (табл. 1). Обычно при ориентировочных расчетах принимают
(см. приложение 1). При этом получаются значения от 0,4*1019 до 2,5*1019 м-2 (табл. 1). Обычно при ориентировочных расчетах принимают
 ; (2)
; (2)
Таблица 1.
Теоретические значения числа молекул в молекулярном слое газа Nпов на 1м2 поверхности
| Газ | He | Ne | H2 | O2 | Ar | N | CO | CO2 | H2O |

| 2.42 | 1.72 | 1.52 | 0.87 | 0.85 | 0.81 | 0.81 | 0.53 | 0.53 |
| Количество газа Q1*102 на 1м2 поверхности при Т»300К в pV-единицах, м2*Па | 9,76 | 6,94 | 6,14 | 3,51 | 3,43 | 3,27 | 3,27 | 2,14 | 2,14 |
П р и м е ч а н и е : Количество газа на 1м2 поверхности в pV-единицах будет равно: 
При заполнении поверхности твердого тела, существенно меньше одного монослой, можно считать количество адсорбированного газа Q пропорциональным давлению p, так как условия поглощения молекул газа поверхностью твердого тела не будут зависеть от заполнения. Для описания процесса адсорбции в этом случае Фрейндлихом предложена эмпирическая формула
 ; (3)
; (3)
где kф и nф - постоянные, зависящие от природы адсорбента и адсорбируемого газа. Уравнение (3) обычно записывают в логарифмической форме:
 ; (4)
; (4)
и тогда в логарифмических координатах оно описывается прямой линией, тангенс угла наклона которой равен 1/nф. При nф=1 между количеством поглощенного газа и давлением существует прямая пропорциональность, аналогичная закону Генри для растворов.
Кривые V=f(р), снятые при постоянной температуре, представляют собой изотермы адсорбции.
Уравнение (4) описывает адсорбцию инертных газов и окиси углерода на угле, водорода на порошке вольфрама при небольших давлениях и соответственно малых заполнениях поверхности.
В стационарном состоянии число адсорбирующихся атомов или молекул должно быть равно числу десорбирующихся:
 ; (5)
; (5)
где a - коэффициент прилипания, характеризующий долю адсорбирующихся молекул на поверхности твердого тела; Nu - число молекул, ударяющихся о единицу поверхности [см. уравнение (8)]; m - число молекул, десорбирующихся в единицу времени с единицы поверхности.
Уравнение (5) можно записать в несколько иной форме. Тогда скорость изменения числа адсорбированных на поверхности молекул равна:
 . (6)
. (6)
В предположении, что адсорбированные молекулы не взаимодействуют между собой, можно считать количество десорбирующихся молекул пропорциональным количеству адсорбированных:
 (7)
(7)
где m1 - число молекул, десорбирующихся при полностью покрытой молекулами газа поверхности; q - коэффициент заполнения поверхности молекулами адсорбированного газа.
Число десорбирующихся с поверхности молекул, очевидно, должно быть обратно пропорционально времени их пребывания в адсорбированном состоянии на поверхности твердого тела, и, таким образом, вместо уравнения (7) можно записать:
 (8)
(8)
где ts - время пребывания молекулы на поверхности в адсорбированном состоянии. Френкелем было предложено следующее выражение для ts:
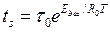 (9)
(9)
где t0 - коэффициент, связанный с периодом колебаний атомов на поверхности адсорбента; Едес - энергия десорбции; Т - температура поверхности; R0 - газовая постоянная.
Коэффициент t0 может меняться в довольно широких пределах в зависимости от свойств материала и газа. Так, например, для инертных газов на графите t0 = (7-10)*10-13 с, на стекле t0»2*10-14 с, для атомарного кислорода на вольфраме t0 = 8*10-14 с, а для атомарного водорода t0=5*10-14 с. В расчетах обычно принимают t0=10-13 с.
Количество адсорбирующихся молекул можно считать пропорциональным доле поверхности, не заполненной газом:
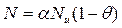 (10)
(10)
В этом случае уравнение (6) запишется в виде
 (11)
(11)
и после преобразования
 (12)
(12)
Если использовать формулы приведенными в предыдущих лекциях, то после подстановки и преобразований получим:
 (13)
(13)
где 
Уравнение (12) описывает гиперболическую изотерму адсорбции Ленгмюра. Значения коэффициента b в уравнении (1З) для ряда систем <газ - металл>, применимых при внешних давлениях меньше 102 Па, приведены отдельно.
При весьма малых давлениях уравнение (12) имеет вид:
 (14)
(14)
т. е. аналогично закону Генри.
В случае, если при адсорбции происходит диссоциация молекул на атомы, для двухатомных газов вместо (10) получим:
 (15)
(15)
так как для адсорбции молекулы на поверхности должны быть свободны две площадки, а для осуществления десорбции на соседних площадках должны быть два атома. В результате для сорбции двухатомного газа в атомарном состоянии имеем:
 (16)
(16)
Для трехатомного газа в формуле (13) вместо квадратного корня должен быть кубический корень. В общем виде можно записать:
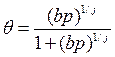 (17)
(17)
Таким образом, уравнение Ленгмюра описывает адсорбцию, в том числе хемосорбцию, в достаточно широком диапазоне давлений. Вместе с тем имеются экспериментальные данные, указывающие на наличие полимолекулярной адсорбции даже при малых значениях коэффициента заполнения q. Применительно к полимолекулярной адсорбции выведено уравнение Брунауеpa - Эмметта - Теллера (БЭТ), объясняющее ход изотерм адсорбции различного вида, записываемое обычно в следующей форме:
 (18)
(18)
где Еад - энергия адсорбции моля газа; Екон - энергия конденсации моля газа; рнас - давление насыщенных паров адсорбируемого вещества при температуре Т.
Отметим, что полимолекулярная адсорбция наблюдается лишь при сравнительно высоких давлениях и значительных энергиях адсорбции.
При низких давлениях, обычно достигаемых в вакуумных системах, уравнение БЭТ сводится к уравнению Ленгмюра, которое мы и будем в основном использовать.
При инженерных расчетах гораздо удобнее вместо количества молекул, с которыми оперируют в уравнениях (10) и (11), использовать значения участвующего в процессах адсорбции газа в рV-единицах. При этом удельные потоки адсорбирующегося и десорбирующегося газа могут быть определены по формулам:
 (19)
(19)
где a - коэффициент прилипания; Nu - число молекул, ударяющихся о единицу поверхности; Т - абсолютная температура;
 (20)
(20)
где N1пов - количество мест на единичной поверхности, которые могут быть заняты адсорбированными молекулами; ls - время пребывания молекулы в адсорбированном состоянии; q - коэффициент заполнения.
Уравнения (3), (13), (17) и (18) позволяют рассчитать количество адсорбированного газа или степени заполнения поверхности в стационарных условиях.
Так, степень заполнения азотом  поверхности образца из железа (Еад =13,7 кДж/моль), находящегося на воздухе (
поверхности образца из железа (Еад =13,7 кДж/моль), находящегося на воздухе (  ) при комнатной температуре, может быть определена по уравнению (13). В предположении, что a=1, получим q = 7,34*10-3, т. е. даже на воздухе в результате физической адсорбции заполняется относительно малая часть поверхности.
) при комнатной температуре, может быть определена по уравнению (13). В предположении, что a=1, получим q = 7,34*10-3, т. е. даже на воздухе в результате физической адсорбции заполняется относительно малая часть поверхности.
При больших энергиях адсорбции на поверхности может быть адсорбировано несколько монослоев. В качестве примера рассчитаем заполнение поверхности бумаги молекулами воды.
Энергия адсорбции воды на бумаге Еад = 142 кДж/моль; энергия конденсации Екон - 45,2 кДж/моль;  ; масса молекулы воды
; масса молекулы воды  Упругость паров воды при температуре 293 К равна pнас=2,337*103 Па. расчет проведем для относительной влажности р/рнас=65%.
Упругость паров воды при температуре 293 К равна pнас=2,337*103 Па. расчет проведем для относительной влажности р/рнас=65%.
Расчет по формуле (18) дает значение q=2,7, что указывает на полимолекулярную адсорбцию.
При низких давлениях и малых энергиях активации адсорбции время установления равновесия может быть достаточно большим.
Расчет количества адсорбированного газа или заполнения поверхности при постоянном
давлении в функции времени может быть осуществлен по уравнению которое приводится к виду
 (21)
(21)
где


Решение уравнения (21) имеет вид:

или (22)
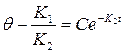
Для адсорбции начальные условия будут при t = 0; q = 0. С учетом начальных условий и (13) получим:
 (23)
(23)
При t ® ¥ уравнение (23) превращается в уравнение (13). Из уравнения (23) можно найти время, за которое достигается степень заполнения поверхности q:
 (24)
(24)
При расчетах по уравнению (24) следует иметь и виду, что значения q не могут превышать его величину при t ® ¥, определенную по соотношениям (13), (17) или (18). Так как отношение K1/K2 = q¥, то уравнение (3-24) можно записать в виде:
 (25)
(25)
где q¥ - заполнение поверхности после длительной экспозиции при заданных условиях.
Можно считать равновесным значением q = 0,99 q¥. Тогда из уравнения (,3-25) получаем время установления адсорбционного равновесия равным:
 (26)
(26)
т. е. при больших давлениях и температурах адсорбционное равновесие устанавливается очень быстро. Так, при температуре 293К и давлении 102 Па адсорбционное равновесие азота на чистой поверхности железа устанавливается примерно за 10-10 с [при расчете по формуле (26) принято значение a=1 и t0 =10-13].
При уменьшении давления в вакуумной системе газ десорбируется с поверхности до тех пор, пока не устанавливается снова динамическое равновесие. Расчет количества десорбирующегося газа можно провести с помощью уравнения (22), но при следующих начальных условиях: t = 0, q = q0
Решение уравнения (22) в этом случае имеет вид:
 (27)
(27)
Удельный поток десорбирующегося газа может быть найден после дифференцирования (27) и умножения результата на  :
:
 (28)
(28)
Максимальная скорость десорбции будет при t=0 и равна:
 (29)
(29)
Обычно уравнение (28) записывается в форме
 (30)
(30)
Время, необходимое для достижения скорости десорбции, равной q’дес можно найти из уравнения (28):
 (31)
(31)
Следует иметь в виду, что так же, как это нами сделано при составлении уравнений (19) и (20), для получения значении удельного потока газа необходимо величины, получаемые с помощью уравнений (28) - (30), умножить на коэффициент T*1.384*10-23 для получения значения потока в м3* Па/(м2*с).
При расчетах удобнее пользоваться формулой, полученной после логарифмирования уравнения (28):
 (32)
(32)
где Адес и Вдес - постоянные, причем
 и
и 
Необходимо указать, что постоянные коэффициенты K1, K2, Адес и Вдес в уравнениях (21) - (32) зависят от давления над поверхностью материала, которое обычно меняется в зависимости от газовыделения в вакуумной системе.
Изложенная теория процессов адсорбции и десорбции показывает, что для уменьшения количества адсорбированного на поверхности твердого тела газа следует повышать температуру материала. Это ясно видно из соотношений (9) и (13).
Поток газовыделения со стенок вакуумном системы может быть найден по формуле
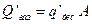 (33)
(33)
где q’дес - удельный поток газа, десорбирующегося с единицы площади поверхности стенки вакуумной системы; А - площадь поверхности стенок вакуумной системы.
В случае, если вакуумная полость ограничивается стенками, изготовленными из разных материалов, газовыделение должно суммироваться из газовыделений всех элементов, ограничивающих вакуумную систему.
Время, необходимое для достижения заданного давления, проще всего найти графически. Для этого надо построить графики Q'газ = f (t), найденные по уравнению (ЗЗ). Затем через точку на оси ординат, соответствующую потоку газов, удаляемых вакуумной системой при заданном давлении, провести горизонтальную прямую до пересечения с кривой скорости газовыделения. Абсцисса точки пересечения даст время достижения заданного давления.
Пользуясь кривыми Q'газ= f (t). можно также решить задачу выбора эффективной быстроты откачки вакуумной системы S0, исходя из заданного времени достижения определенного давления.
Как уже указывалось, расчет по уравнению с использованием данных приложения 2 и рис.1 и 2 позволяет определить время достижения заданного давления при комнатной температуре.
|
|

Газовыделение и время достижения заданного давления при известной энергии адсорбции и температуре можно найти, исходя из уравнений (11) и предыдущих лекций, причем последнее уравнение записывается с учетом процессов сорбции и десорбции газа и имеет вид:
 (34)
(34)
где V - откачиваемый объем; р - давление в откачиваемом объеме; So - эффективная быстрота откачки; a - коэффициент прилипания; V1 - объем газа, падающий на единицу площади в единицу времени; А - площадь стенок откачиваемого объема; Q1 - количество газа, содержащегося в монослое на единице поверхности; q - коэффициент заполнения поверхности; ts - время пребывания молекулы на поверхности .в адсорбированном состоянии [см. (9)]. Уравнение (11) запишем в следующей форме
 (35)
(35)
Множитель (1 - q) и этой формуле не учитывают, так как при давлениях, обычно достигаемых в вакуумных системах для физической адсорбции, коэффициент заполнения q существенно меньше единицы и поэтому 1 - q » 1.
Для определения давления продифференцируем уравнение (34) по времени:
 (36)
(36)
Подставляя в уравнение (36) значение  из (35) и
из (35) и  из уравнения (34), получаем:
из уравнения (34), получаем:
 (37)
(37)
Общее решение уравнения (37) записывается в форме
 (38)
(38)
Коэффициенты S1 и S2 находятся в соответствии с общими правилами решения дифференциальных линейных уравнений второго порядка:
 (39)
(39)
Используя начальные условия при t = 0; р = рнач и
 (40)
(40)
из следующей системы уравнений:
 (41)
(41)
находим постоянные интегрирования
 (42)
(42)
 (43)
(43)
Обычно произведение bрнач принимается равным q0 - начальному значению коэффициента заполнения поверхности.
Уравнение (38) позволяет определить длительность откачки до заданного давления.
Связь между рнач и q0 может быть найдена из (13) или (14). Укажем, что при составлении уравнений (34) - (36) было бы более правильно воспользоваться уравнением (11), но при этом будет получено нелинейное дифференциальное уравнение, решение которого в общем виде затруднительно.
В связи с изложенным можно рекомендовать использование уравнения (40) только при весьма малых давлениях, когда q гораздо меньше единицы.
Учитывая, что при определении S1 приходится иметь дело с разностью близких величин, целесообразно воспользоваться разложенном в степенной ряд, что применительно к нашему случаю даст:
 (43)
(43)
Обычно с достаточной для практических расчетов точностью (примерно 1%) можно считать, что
 (45)
(45)
Фактическая площадь поверхности стенок откачиваемого сосуда может на порядок и более превышать геометрическую площадь поверхности. Это обстоятельство следует учитывать также и при расчетах по формулам (42) и (43).
Пример 1.Определить время, необходимое для откачки камеры с внутренним диаметром 260 мм н высотой 250 мм, изготовленной из малоуглеродистой стали, от давления 6,7*10-1 Па до давления 6,7*10-3 Па. Суммарная площадь поверхности фторопластовых уплотнителей, обращенных в вакуумную полость, равна 50 см2. Эффективная быстрота откачки вакуумной системы при давлении 6,7*10-3 Па равна S0=10-2 м2/с.
В области давлений меньше 6,7*10-1 Па при расчете длительности откачки до заданного давления практически можно пренебречь газом, находящимся в объеме, и следует учитывать лишь необходимость удаления адсорбированного на стенках газа. Связано это с тем, что в мономолекулярном слое адсорбированного газа на каждом квадратном метре поверхности содержится примерно 2*10-2 м3*Па газа (см. табл. 1 для H2O).

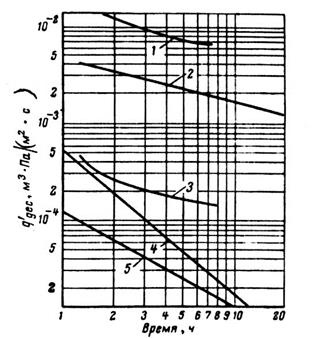
Рис. 3 Газовыделение вакуумной камеры.
1 - суммарное газовыделение с поверхностей стенок и уплотнителя; 2 – газовыделение с поверхностей стенок камеры; 3 - газовыделение с поверхности уплотнителя, изготовленного из фторопласта.
Покажем это следующим простейшим расчетом.
Площадь поверхности металлических стенок камеры будет:
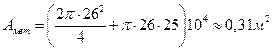
Таким образом, только на металлических поверхностях камеры, если полагать, что истинная поверхность примерно в 3 раза превышает геометрическую (камера полированная), будет находиться следующее количество газа:

Объем камеры равен:

и при давлении 6,7*10-1 Па в нем сосредоточено

газа, а удаляется находящийся в объеме газ гораздо быстрее.
Решим задачу графически с использованием кривых удельной скорости газовыделения малоуглеродистой стали и фторопласта, приведенных соответственно на рис. 1 и 2.
Для этого, умножив ординаты кривой на рис. 1 на 3100см2 и на рис. 2 на 50 см2, получим кривые, характеризующие скорости газовыделения и камере (кривые 2 и 3 на рис. 3). Сложим ординаты полученных кривых и построим кривую 1 скорости суммарного газовыделения.
Поток газов, удаляемых вакуумной системой, равен:

Теперь через точку  на оси ординат проведем горизонталь до пересечения с кривой 1 скорости суммарного газовыделения. В результате получим, что давление р=6,7*10-3 Па будет достигнуто примерно через 2,4 ч.
на оси ординат проведем горизонталь до пересечения с кривой 1 скорости суммарного газовыделения. В результате получим, что давление р=6,7*10-3 Па будет достигнуто примерно через 2,4 ч.
Пример 2. Определить парциальное давление азота в вакуумном объеме диаметром 10 см и высотой 8 см, изготовленном из стали, после охлаждения его от температуры Т1=673 К до T2 =293 К. При температуре 673 К давление азота составляло рнач = 2,7*10-4 Па.
При указанных давлениях изотерма сорбции описывается уравнением (14). Энергия физической адсорбции азота на стали равна 8,9 кДж/моль, а энергия хемосорбции - 167 кДж/моль.
Сначала рассчитаем давление в объеме после остывания, предполагая наличие лишь физической адсорбции. В этом случае время пребывания молекулы на поверхности будет:

Примем коэффициент прилипания a=1. Масса молекулы азота (см. приложение 1) равна 4,652*10-26 кг. Объем равен:

Геометрическая поверхность стенок вакуумного объема равна:

Обычно для компактных материалов можно считать фактическую или истинную поверхность больше геометрической в 3 - 8 раз.
Предположим, что в нашем случае это соотношение равно пяти, и тогда площадь внутренней поверхности вакуумного объема равна:

Если предположить, что при температуре 673 К весь газ сосредоточен в объеме, то начальная концентрация азота будет равна:

Кроме того, используя уравнение (14) можно записать:

где Nпов и N1 - концентрации газа на поверхности и в объеме соответственно после охлаждения стенок.
В результате можно составить следующую систему уравнении:

Откуда
 (46)
(46)
В случае хемосорбции время пребывания молекулы на поверхности

и в соответствии с уравнением (46)

т. е. за счет хемосорбции после остывания давление в сосуде будет пренебрежимо мало.
На практике всегда при остывании происходит некоторое газовыделение из стенок и давление в сосуде окажется существенно большим, чем получается из расчетов с учетом только сорбционных явлений.
Пример 3. Определить время, необходимое для откачки до давления р=10-7 Па стальной цилиндрической камеры диаметром 0,15 м и высотой 0,2 м, предварительно заполненной водородом.
Эффективная быстрота откачки камеры S0 = 10-3 м3/с и не зависит от давления.
Принимаем коэффициент прилипания a = 0,5. Кроме того, полагаем, что фактическая поверхность стенок камеры в 10 раз больше геометрической площади поверхности.
Геометрическая площадь поверхности стенок откачиваемой камеры равна А=0,1296м2. Фактическая поверхность стенок камеры будет равна, таким образом, Афакт=1,296 м2. Объем камеры V=3,54*10-3 м3.
Из табл. 1 для водорода находим, что N1пов = 1,52*1019 м-2 и Q1пов = 6,14*10-2 м3*Па/м2.
Из приложения 1 имеем МН2 = 2,016 и mH2 = 0,3347*10-26кг.
Энергия адсорбции для системы Н2 - Fe равна Еад=134 кДж/моль.
Принимаем начальный коэффициент заполнения поверхности q0=1.
Проведем расчет длительности откачки камеры до заданного давления р=10-7 Па.
Время предварительной откачки до давления, устанавливающегося при 60=1, не учитываем ввиду относительной его малости.
1. Рассчитываем длительность откачки при температуре Т= 523 К (250°С).
По формуле (9) находим время пребывания молекулы водорода на поверхности в адсорбированном состоянии

Определяем объем газа, падающий на единицу площади поверхности:

Находим в соответствии с выражениями (13) и (14) начальное давление, учтя при этом принятое нами соотношение между фактической и геометрической площадями поверхности стенки камеры и q =1:

Теперь по формулам (44) и (45) находим показатели степени в уравнении (38):

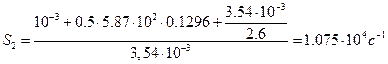
Находим по формулам (42) и (43) значения постоянных интегрирования:

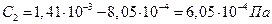
В результате в соответствии с (38) получаем следующее уравнение, характеризующее изменение давления в откачиваемой камере:

Таким образом, заданное давление > откачиваемой камере будет достигнуто по истечении времени t = 8,9-105с = 247 ч, т. е. при температуре 250°С для получения заданного давления потребуется более 10 суток непрерывной откачки.
2. Рассчитаем длительность откачки той же камеры до заданного давления при температуре 623К (350°С).
При что температуре время пребывания молекулы водорода на поверхности в адсорбированном состоянии равно:

Объем газа, падающего на единицу поверхности, равен:
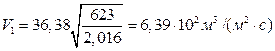
Начальное давление при температуре камеры 623К будет равно:

Определяем показатели степени в уравнении (38):

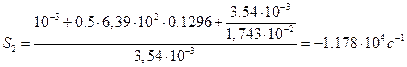
Находим значения постоянных интегрирования:


В результате получаем следующее уравнение, характеризующее изменение давления в откачиваемой камере:

Таким образом, при температуре 623 К заданное давление будет достигнуто за время t=1,079*104с » З ч. Данный пример показывает эффективность повышения температуры прогрева сосудов при их откачке. В самом деле, повышение температуры всего на 100°С (с 250 до 350°С) позволило ускорить процесс достижения заданного давления более чем в 80 раз.
Для анализа динамики изменения давления в откачиваемых объемах можно рекомендовать следующее правило:
если частное от деления энергии десорбции на температуру
Eдес / T £. 2*102 Дж/(моль*К), то объем откачивается достаточно быстро;
если частное от деления энергии десорбции на температуру
Eдес / T > 3*102 Дж/(моль*К), то газы удаляются весьма медленно, но начальное давление в объеме даже при относительно малой эффективной быстроте откачки будет незначительным.
|
из
5.00
|
Обсуждение в статье: Определение времени обеэгаживания |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

