 |
Главная |
Материальный баланс процесса горения
|
из
5.00
|
МИНОБРНАУКИ РОССИИ
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«Югорский государственный университет»
ПОЛИТЕХНИЧЕСКИЙ ИНСТИТУТ
Кафедра «Физико-химии процессов и материалов»
А.В. Долматов, П.Ю. Гуляев, И.В. Милюкова
Физико-химия горения и взрыва
Учебное пособие по решению задач
Часть I
г.Ханты-Мансийск
2012 г.
УДК 536.1+544.45
Долматов Алексей Викторович, Гуляев Павел Юрьевич, Милюкова Ирина Васильевна
Физико-химия горения и взрыва: учебное пособие по решению задач. Часть 1. – Ханты-Мансийск: ЮГУ, 2012. – 64 с.
В брошюре представлены методические рекомендации к решению задач по физико-химии горения и взрыва.
Рекомендовано студентам, обучающимся по специальности 150701.65 – «Физико-химия процессов и материалов» и по направлению подготовки бакалавров 150100.62 – «Материаловедение и технологии материалов» с профилем 150100.62.00.02 – «Физико-химия процессов и материалов», а также других инженерных специальностей очной и заочной форм обучения, изучающим курс «Теория горения и взрыва».
Рецензент: д.ф.-м.н., профессор А.В. Вьюн
УДК 536.1+544.45
© Югорский государственный университет, 2012
Содержание:
| 1. Основные понятия физико-химии процесса горения…….... | |
| 2. Материальный баланс процесса горения……………………. | |
| 2.1. Практическое занятие №1 «Расчет количества окислительной среды»………………………............................ | |
| 2.2. Практическое занятие №2 «Расчет объема и состава продуктов горения»…………………………………………… | |
| 3. Тепловой баланс горения………………………….................. | |
| 3.1. Практическое занятие №3 «Расчет теплотворной способности топлива»…………………………………………. | |
| 3.2. Практическое занятие №4 «Расчет адиабатической температуры горения и взрыва»……..……………………….. | |
| 4. Литература……………………………………………………... |
Основные понятия физико-химии процесса горения
Пламя –явление, вызванное свечением среды нагретой до высокой температуры.
Горение – сложный, быстропротекающий физико-химический процесс, в котором выделение тепла приводит к образованию пламени.
Например, горение каменного угля, состоящего в основном из углерода:
 ;
;  кДж/моль (1.1)
кДж/моль (1.1)
где  – энтальпия химической реакции, указывающая, что при сгорании 12 грамм углерода (
– энтальпия химической реакции, указывающая, что при сгорании 12 грамм углерода (  = 1 моль) выделяется 393.5 кДж энергии в форме теплоты.
= 1 моль) выделяется 393.5 кДж энергии в форме теплоты.
 , (1.2)
, (1.2)
где 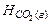 ,
,  и
и 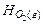 - энтальпии образования углекислого газа, твердого углерода и газообразного кислорода при нормальных физических условиях [1,2].
- энтальпии образования углекислого газа, твердого углерода и газообразного кислорода при нормальных физических условиях [1,2].
Химическая реакция называется экзотермической, если при нормальных физических условиях энтальпия конечных продуктов реакции меньше, чем исходных компонентов. Тогда в ходе реакции происходит уменьшение теплосодержания вещества (  ) и выделение теплоты в окружающую среду.
) и выделение теплоты в окружающую среду.
Химическая реакция называется эндотермической, если при нормальных физических условиях энтальпия конечных продуктов реакции больше, чем исходных компонентов. Тогда в ходе реакции происходит увеличение теплосодержания вещества (  ) и поглощение теплоты из окружающей среды.
) и поглощение теплоты из окружающей среды.
Горение в большинстве случаев представляют собой окислительно-восстановительные реакции. Под этим понимают процессы изменения степени окисления элементов.
Степень окисления – это условный заряд атома в соединении, вычисленный исходя из предположения, что образуется ионное соединение.
Окислитель - вещество, которое восстанавливается и снижает свою степень окисления.
Восстановитель (горючее) -вещество, который окисляется и увеличивает свою степень окисления.
Например, горение водорода:
 или
или  .
.
Степень окисления водорода и кислорода в простых веществах принята равной нулю. После реакции степень окисления кислорода стала – 2, а водорода +1.
Горением может быть любая реакция двух веществ между собой. Например, горение водорода в атмосфере хлора:
 или
или  .
.
Здесь водород является горючим, хлор – окислителем, а пламя образуется в результате свечения газообразной среды, вызванное релаксацией содержащихся в ней ионов и радикалов [3].
Волна горения представляет собой самоорганизованный комплекс, в котором локализованная химическая реакция, перемещаясь в пространстве реагентов, переводит их в продукты реакции. Волна горения характеризуется пламенем, вид которого зависит от агрегатного состояния реагентов и продуктов реакции. Таким образом, пламя может возникать не только в газообразной среде. Известны системы, в которых горение твердых компонентов сопровождается образованием жидкой фазы, химическое превращение идет в расплаве, а при распространении волны горения возникает явление жидкого пламени[4] .
Жидкое пламя наблюдается в алюминотермических процессах самораспространяющегося высокотемпературного синтеза (СВС), протекающих по схеме
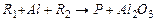 ,
,
где  ,
,  - твердые вещества исходной смеси,
- твердые вещества исходной смеси, 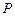 - продукт реакции. Здесь алюминий выступает в роли восстановителя (горючего), а температура горения настолько высока, что превышает температуры плавления всех реагентов и продуктов
- продукт реакции. Здесь алюминий выступает в роли восстановителя (горючего), а температура горения настолько высока, что превышает температуры плавления всех реагентов и продуктов
 ,
,
где  ,
,  ,
,  ,
,
 ,
, 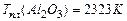 ,
,  - адиабатическая температура горения.
- адиабатическая температура горения.
Разновидностью безгазового горения является СВС с промежуточным расплавленным слоем. Здесь один или оба порошковых реагента при горении плавятся, а продукт образуется в твердом состоянии
 ,
,  ;
;
 ,
, 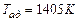 ;
;
 ,
,  ;
;
 ,
,
где  ,
,  . Как видно из примера, в зависимости от состава исходной смеси могут быть реализованы реакции горения с образованием различных продуктов - интерметаллидов. Любопытно отметить, что в этих реакциях горения алюминий играет роль окислителя.
. Как видно из примера, в зависимости от состава исходной смеси могут быть реализованы реакции горения с образованием различных продуктов - интерметаллидов. Любопытно отметить, что в этих реакциях горения алюминий играет роль окислителя.
Предельной разновидностью горения является явление твердого пламени, когда твердые вещества смешиваются посредством реакционной диффузии и сгорают без образования жидкой или газовой фазы. Твердофазное безгазовое горение наблюдается в смесях порошков тугоплавких металлов (Ta, Nb, Mo) c бором и углеродом, а также во многих других системах при сильном разбавлении смеси конечным продуктом, когда температура горения становится меньше температуры плавления всех реагентов и продуктов [5, 6, 7].
Взрыв– физико-химический процесс, сопровождающийся выделением большого количества энергии в ограниченном объеме за короткий промежуток времени [8].
Взрыв является разновидностью горения. При химических превращениях он, как правило, наблюдается в гомогенных смесях горючего и окислителя, где процессы диффузии не ограничивают скорости процесса. В отличие от горения при взрыве поток теплоты в окружающую среду меньше скорости тепловыделения. Как следствие, увеличение температуры реагентов ведет, в соответствие с законом Аррениуса, к экспоненциальному росту скорости химической реакции. В итоге, в ограниченном объеме реагентов практически мгновенно выделяется большое количество теплоты, которая перегревает продукты реакции, вызывая взрыв.
Материальный баланс процесса горения
Топливомназывают смесь горючих веществ.
Окислительной средой будем называть смесь окислителя и инертного вещества (смеси веществ), которое не участвует в реакции горения.
Наиболее распространенным процессом горения является реакция окисления в атмосфере воздуха. При этом окислительной средой является воздух; окислителем - кислород воздуха, а инертным газом при температурах ниже 25000С можно считать азот воздуха.
Под нормальными физическими условиями понимают следующие значения температуры и давления:

 . (2.1)
. (2.1)
Состав атмосферного воздуха достаточно сложен. Однако объем второстепенных компонентов в сухом очищенном воздухе менее 1%. Поэтому будем считать, что воздух состоит из двух компонентов – кислорода и азота. Более подробные характеристики воздуха при нормальных физических условиях приведены в таблице 2.1.
Таблица 2.1. Характеристики воздуха при нормальных условиях
| Газ | Состав |  ∙10-3
кг/моль ∙10-3
кг/моль
| r, кг/м3 | R', Дж/(кг×К) | VM∙10-3, м3/моль | |
| масс. % | объем. % | |||||
| Кислород | О2 | О2 | 32.00 | 1.429 | 259.7 | 22.393 |
| Азот | N2 | N2 | 28.013 | 1.251 | 296.65 | 22.395 |
| Воздух | 23% О2 77% N2 | 21% О2 79% N2 | 28.96 | 1.293 | 281.53 | 22.398 |
В таблице приняты следующие обозначения  – молярная масса,
– молярная масса,  - плотность газовой фазы,
- плотность газовой фазы, 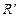 - газовая постоянная,
- газовая постоянная, 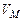 - объем, занимаемый одним молем газа.
- объем, занимаемый одним молем газа.
Расчет материального баланса при горении топлив в окислительной среде сводится к решению двух задач [9]:
1.Определение количества окислительной среды;
2.Определение количества и состава продуктов сгорания.
Если процесс горения происходит с участием окислительной среды, параметры которой отличаются от нормальных, то ее плотность рассчитывается с помощью уравнения состояния (уравнения Клапейрона–Менделеева):
 , (2.2)
, (2.2)
где  - абсолютная температура,
- абсолютная температура,  - газовая постоянная, равная отношению универсальной газовой постоянной
- газовая постоянная, равная отношению универсальной газовой постоянной  и молярной массы газа. При этом соотношение параметров состояния при нормальных и заданных физических условиях можно выразить формулой
и молярной массы газа. При этом соотношение параметров состояния при нормальных и заданных физических условиях можно выразить формулой
 . (2.3)
. (2.3)
Согласно закону Авогадро, 1 моль любого газа при нормальных условиях имеет один и тот же объем  м3/моль. При произвольных значениях p, T молярный объем можно вычислить по формуле
м3/моль. При произвольных значениях p, T молярный объем можно вычислить по формуле
 . (2.4)
. (2.4)
Расчет материального баланса процессов горения выполняют при нормальных физических условиях, а по его завершению количественные характеристики горючего, окислителя и продуктов сгорания приводят к заданным условиям с помощью (2.3) и (2.4).
Уравнение химической реакции горения запивают в виде
 , (2.5)
, (2.5)
где  - стехиометрические коэффициенты исходных компонентов и продуктов реакции соответственно;
- стехиометрические коэффициенты исходных компонентов и продуктов реакции соответственно;  - химические формулы исходных веществ и продуктов горения. При этом стехиометрические коэффициенты связаны
- химические формулы исходных веществ и продуктов горения. При этом стехиометрические коэффициенты связаны  - условиями
- условиями
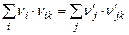 , (2.6)
, (2.6)
где  - количество атомов
- количество атомов  элемента в
элемента в  -ом исходном веществе;
-ом исходном веществе;  - количество атомов
- количество атомов  элемента в
элемента в  -ом продукте сгорания. Все произведения
-ом продукте сгорания. Все произведения  и
и  в (2.6) должны быть целыми числами.
в (2.6) должны быть целыми числами.
Отношение стехиометрических коэффициентов при кислороде и горючем
 , (2.7)
, (2.7)
показывает сколько моль кислорода потребуется для сжигания 1 моля горючего. Так как молярный объем все газов при нормальных условиях одинаков, то
 (2.8)
(2.8)
отношение стехиометрических коэффициентов также показывает, какой объем кислорода потребуется для сжиганий 1 м3 горючего.
Когда в качестве горючего используется смесь газов, то количество кислорода, необходимого для сжиганий 1 м3 смеси, можно найти по формуле
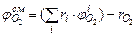 , (2.9)
, (2.9)
где 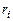 - объемная доля
- объемная доля  -ого горючего в 1 м3 смеси;
-ого горючего в 1 м3 смеси;  - количество кислорода, которое необходимо для сжигании 1 м3
- количество кислорода, которое необходимо для сжигании 1 м3  -ого горючего из смеси;
-ого горючего из смеси;  - объемная доля кислорода, содержащегося в горючей смеси.
- объемная доля кислорода, содержащегося в горючей смеси.
При сжигании жидких и твердых горючих рассчитывают удельную массу кислорода, которая требуется для сжигания 1 кг горючего
 , (2.10)
, (2.10)
где  и
и  - молярная масса кислорода и горючего.
- молярная масса кислорода и горючего.
Массу кислорода, которая требуется для сжигания 1 кг топлива, можно определить по формуле
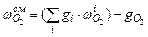 , (2.11)
, (2.11)
где  - массовая доля
- массовая доля  -ого горючего вещества в топливной смеси;
-ого горючего вещества в топливной смеси;  - масса кислорода, необходимая для сжигания 1 кг
- масса кислорода, необходимая для сжигания 1 кг  -ого горючего вещества топливной смеси;
-ого горючего вещества топливной смеси;  - массовая доля кислорода, содержащегося в топливе.
- массовая доля кислорода, содержащегося в топливе.
Количество окислительной среды можно найти, используя (2.8) - (2.11), следующим образом
 ;
; 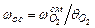 , (2.12)
, (2.12)
где  - объемная доля кислорода в окислительной среде, а
- объемная доля кислорода в окислительной среде, а  - массовая доля кислорода в окислительной среде. Если в качестве окислительной среды выступает воздух, то
- массовая доля кислорода в окислительной среде. Если в качестве окислительной среды выступает воздух, то  , а
, а  .
.
Обозначим  ,
,  ,
,  - соответственно теоретические масса, объем и количество моль окислительной среды, необходимые для полного сжигания горючего;
- соответственно теоретические масса, объем и количество моль окислительной среды, необходимые для полного сжигания горючего;  ,
,  ,
, 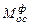 - соответственно фактические масса, объем и количество моль окислительной среды, которая участвовала в процессе горения. Тогда коэффициентом избытка окислительной среды называется
- соответственно фактические масса, объем и количество моль окислительной среды, которая участвовала в процессе горения. Тогда коэффициентом избытка окислительной среды называется
 . (2.13)
. (2.13)
При  смесь называется стехиометрической;
смесь называется стехиометрической;  смесь называется бедной, так как в ней недостаточно горючего для использования всего кислорода окислительной среды;
смесь называется бедной, так как в ней недостаточно горючего для использования всего кислорода окислительной среды;  смесь называется богатой, так как в ней горючего больше того количества, которое можно сжечь кислородом окислительной среды [10].
смесь называется богатой, так как в ней горючего больше того количества, которое можно сжечь кислородом окислительной среды [10].
Теоретически при  после сгорания смеси в ней должны присутствовать только продукты полного сгорания и инертный газ окислительной среды, а температура продуктов сгорания должна быть наибольшей по сравнению со смесями, где
после сгорания смеси в ней должны присутствовать только продукты полного сгорания и инертный газ окислительной среды, а температура продуктов сгорания должна быть наибольшей по сравнению со смесями, где  больше или меньше единицы.
больше или меньше единицы.
При сжигании смесей с  к продуктам горения относят продукты полного сгорания, инертный газ окислительной среды и избыточный кислород, для которого не хватило горючего.
к продуктам горения относят продукты полного сгорания, инертный газ окислительной среды и избыточный кислород, для которого не хватило горючего.
Продуктами горения смесей с  являются продукты полного и неполного сгорания, продукты термического разложения горючего и инертный газ окислительной среды.
являются продукты полного и неполного сгорания, продукты термического разложения горючего и инертный газ окислительной среды.
Знание количества и состава продуктов горения необходимо для расчета важнейших характеристик процесса горения – температуры горения, температуры взрыва, давления при взрыве. Поскольку продукты сгорания находятся, как правило, в газообразном состоянии, их состав выражается либо в объемных процентах, либо в м3 на 1 кг горючего вещества.
В общем случае в качестве топлива выступает смесь горючих веществ, поэтому в процессе ее сгорания одновременно протекают  химических реакций. Обозначим:
химических реакций. Обозначим: 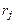 и
и  - объемная и массовая доля горючего вещества в смеси;
- объемная и массовая доля горючего вещества в смеси;  - стехиометрический коэффициент при горючем в
- стехиометрический коэффициент при горючем в  - ой химической реакции;
- ой химической реакции;  - стехиометрический коэффициент при
- стехиометрический коэффициент при  -ом продукте в
-ом продукте в  -ой реакции;
-ой реакции;  - удельный объем
- удельный объем  продукта реакции на 1 м3 топлива;
продукта реакции на 1 м3 топлива;  - удельный объем инертного газа окислительной среды, вошедшего в продукты реакции, на 1 м3 топлива;
- удельный объем инертного газа окислительной среды, вошедшего в продукты реакции, на 1 м3 топлива;  - удельный объем окислителя (кислорода), вошедшего в продукты реакции, на 1 м3 горючей смеси.
- удельный объем окислителя (кислорода), вошедшего в продукты реакции, на 1 м3 горючей смеси.
Полное сгорание 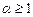 . В этом случае количество каждого продукта для газообразного топлива рассчитывают по формулам (2.14)-(2.17):
. В этом случае количество каждого продукта для газообразного топлива рассчитывают по формулам (2.14)-(2.17):
 ,
,  , (2.14)
, (2.14)
где  - количество реакций горения,
- количество реакций горения,  - количество веществ, образующихся во всех реакциях горения;
- количество веществ, образующихся во всех реакциях горения;

 , (2.15)
, (2.15)
 , (2.16)
, (2.16)
где  - объем окислителя (кислорода) на 1 м3 топливной смеси, который требуется для протекании горения при стехиометрических условиях;
- объем окислителя (кислорода) на 1 м3 топливной смеси, который требуется для протекании горения при стехиометрических условиях;  - объемная доля кислорода в окислительной среде;
- объемная доля кислорода в окислительной среде;
 , (2.17)
, (2.17)
где  - общий объем продуктов на 1 м3 горючей смеси.
- общий объем продуктов на 1 м3 горючей смеси.
Количество продуктов сгорания для жидких и твердых топлив рассчитывают по формулам (2.18)-(2.21)
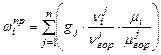 ,
,  , (2.18)
, (2.18)
где  - количество реакций горения,
- количество реакций горения,  - количество веществ, образующихся во всех реакции горения;
- количество веществ, образующихся во всех реакции горения;

 , (2.19)
, (2.19)
 , (2.20)
, (2.20)
где  - масса инертного газа окислительной среды на 1 кг топливной смеси, вошедшего в продукты горения;
- масса инертного газа окислительной среды на 1 кг топливной смеси, вошедшего в продукты горения;  - масса окислителя (кислорода) на 1 кг топливной смеси, который требуется для протекании горения при стехиометрических условиях;
- масса окислителя (кислорода) на 1 кг топливной смеси, который требуется для протекании горения при стехиометрических условиях;  - массовая доля кислорода в окислительной среде;
- массовая доля кислорода в окислительной среде;
 , (2.21)
, (2.21)
где  - общая масса продуктов на 1 кг топливной смеси.
- общая масса продуктов на 1 кг топливной смеси.
Составом продуктов сгорания называют совокупность их объемных или массовых долей, которые вычисляются с помощью формул (2.22) и (2.23)
 , (2.22)
, (2.22)
 , (2.23)
, (2.23)
 - количество веществ, образующихся во всех реакциях горения.
- количество веществ, образующихся во всех реакциях горения.
Неполное сгорание  [10]. Если количество кислорода в топливно-воздушной смеси меньше стехиометрического, то окисление будет неполным. При неполном окислении часть углерода
[10]. Если количество кислорода в топливно-воздушной смеси меньше стехиометрического, то окисление будет неполным. При неполном окислении часть углерода 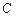 окисляется до оксида углерода
окисляется до оксида углерода  , а часть водорода
, а часть водорода  не сгорает вообще. В этом случае окисление молекулы
не сгорает вообще. В этом случае окисление молекулы  идет по приведенному ниже уравнению
идет по приведенному ниже уравнению

 , (2.24)
, (2.24)
где  - доля углерода окислившаяся до
- доля углерода окислившаяся до  ;
;  - доля несгоревшего водорода.
- доля несгоревшего водорода.
Коэффициенты  и
и  в общем случае взаимосвязаны между собой. Из уравнения (2.24) следует, что соотношение между
в общем случае взаимосвязаны между собой. Из уравнения (2.24) следует, что соотношение между  и
и  в продуктах неполного сгорания (из-за недостатка кислорода) имеет вид
в продуктах неполного сгорания (из-за недостатка кислорода) имеет вид
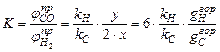 , (2.25)
, (2.25)
где  ,
,  - массовая доля углерода и водорода в горючем, которые можно вычислить так:
- массовая доля углерода и водорода в горючем, которые можно вычислить так:
 ;
;  . (2.26)
. (2.26)
На основе эксперимента установлено, что величину  можно приближенно выразить как функцию состава горючего:
можно приближенно выразить как функцию состава горючего:
 . (2.27)
. (2.27)
Количество отдельных компонентов продуктов неполного сгорания по углероду и водороду для можно рассчитать по формулам:
 , (2.28)
, (2.28)
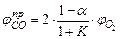 , (2.29)
, (2.29)
 , (2.30)
, (2.30)
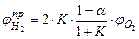 , (2.31)
, (2.31)

 . (2.32)
. (2.32)
Общее количество продуктов неполного сгорания горючего вещества:
 . (2.33)
. (2.33)
Состав продуктов сгорания рассчитывают с помощью формул (2.22) или (2.23).
Практическая работа №1
«Расчет количества окислительной среды»
Цель: Расчет количества кислорода и окислительной среды для сжигания индивидуальных веществ и их смесей, а также сложных веществ, представленных элементарным составом.
Расчетные формулы и алгоритмы
Порядок расчета материального баланса процесса горения зависит от вида топлива, которое подразделяют на [11]:
1.индивидуальное вещество;
2.смесь веществ;
3.сложное вещество, представленное элементарным составом.
Общий алгоритм расчета выглядит таким образом:
1.Для топлив вида 2 и 3 выделяют вещества и элементы, которые могут вступать в реакцию с окислителем (кислородом).
2.Записывают для каждого горючего вещества или элемента уравнение реакции с окислителем (2.6) и подбирают стехиометрические коэффициенты так, чтобы выполнялись условия (2.7).
3.Для каждого уравнения горения, записанного в пункте 2, определяют количество кислорода, которое потребуется для сжигания единицы топлива. Для газообразного горючего используют формулу (2.8), чтобы найти объем окислителя (кислорода), необходимого для сжигания 1 м3 горючего. Для жидких и твердых горючих используют формулу (2.11), чтобы вычислить массу кислорода, который потребуется для сжигания 1 кг горючего.
4.В зависимости от типа горючего используют формулу (2.13), чтобы определить количество воздуха (или другой окислительной среды) для стехиометрической смеси с горючим.
5.По формуле (2.5) находят фактическое количество воздуха (или другой окислительной среды), подаваемое для сжигания горючего.
6.С помощью формул (2.2)-(2.4) приводят количественные характеристики к заданным внешним условиям.
Пример 1.1. Найдите объем воздуха для сжигания 40 литров пропана при  и температуре смеси 500С.
и температуре смеси 500С.
Решение. Запишем уравнение реакции горения пропана в кислороде воздуха, используя форму (2.6)
 ,
,
здесь 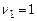 ,
,  ;
;  ,
, 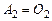 ;
; 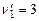 ,
,  ;
;  ,
,  .
.
Все вещества, связанные уравнением горения, содержат три элемента: углерод, водород и кислород. Поэтому должны выполняться 3 условия типа (2.7)
· для углерода:  ;
;
· для водорода:  ;
;
· для кислорода:  .
.
Так условия по каждому элементу выполнены, то стехиометрические коэффициенты в реакции горения подобраны правильно. Теперь можно рассчитать количество кислорода, которое потребуется для сжиганий 1 м3 пропана, по формуле (2.9)
 [м3 кислорода/м3 пропана].
[м3 кислорода/м3 пропана].
По формуле (2.13) находим объем воздуха, необходимый для образовании стехиометрической смеси с горючим
 [м3 воздуха/м3 пропана].
[м3 воздуха/м3 пропана].
По условию задачи фактически воздуха было взято в 1,3 раза больше, поэтому для сжигания 1 м3 пропана потребуется
 [м3 воздуха/м3 пропана].
[м3 воздуха/м3 пропана].
Так как сжигается всего 40 литров пропана; в единицах СИ 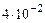 м3, то абсолютное количество воздуха при нормальных условиях составит
м3, то абсолютное количество воздуха при нормальных условиях составит
 м3.
м3.
Смесь находилась в условиях отличных от нормальных, поэтому потребуется рассчитать объем воздуха при температуре 500С, что по термодинамической шкале температур составляет Т=323К
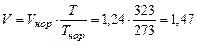 м3.
м3.
Ответ: 
 .
.
Пример 1.2. Определить коэффициент избытка воздуха при горении уксусной кислоты, если на горение 1 кг поступило 3 м3 воздуха.
Решение. Запишем уравнение реакции уксусной кислоты с кислородом воздуха
 .
.
По формуле (2.11) вычислим массу кислорода, который потребуется для стехиометрической смеси с горючим
 [кг кислорода/кг гор.].
[кг кислорода/кг гор.].
Так как 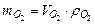 , то
, то  .
.
Плотность кислорода при нормальных условиях можно определить с помощью (2.2)
 кг/м3.
кг/м3.
Тогда
 [м3 кислорода / кг горючего].
[м3 кислорода / кг горючего].
Количество воздуха в стехиометрической смеси с горючим должно составлять
 [м3 воздуха].
[м3 воздуха].
По условию задачи фактический объем используемого воздуха составил  м3. Коэффициент избытка воздуха найдем по формуле (2.5):
м3. Коэффициент избытка воздуха найдем по формуле (2.5):  .
.
Ответ:  .
.
Пример 1.3. На сжигание 4 м3 горючей смеси состава:  ,
,  ,
,  ,
,  ,
,  об. % пошло 20 м3 окислительной среды. Вычислите объемную долю кислорода в окислительной среде, содержащей также инертный газ. Смесь окислительной среды с горючим считать стехиометрической.
об. % пошло 20 м3 окислительной среды. Вычислите объемную долю кислорода в окислительной среде, содержащей также инертный газ. Смесь окислительной среды с горючим считать стехиометрической.
Решение. Из веществ, входящих в состав горючей смеси, в реакцию с кислородом не вступают углекислый газ и водяные пары, т.к. они являются продуктами полного сгорания. Для остальных веществ запишем уравнения горения:
(1)  ;
;
(2) 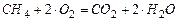 ;
;
(3)  .
.
Стехиометрические коэффициенты при кислороде в уравнениях (1) и (3) могут быть дробными, так их произведение с количеством атомов в молекуле кислорода дает целое число. По уравнениям горения найдем объем кислорода, который требуется для получения стехиометрической смеси с каждым горючим веществом: (1)  [м3 О2 / м3 С2Н2];
[м3 О2 / м3 С2Н2];  [м3 О2 / м3 СН4];
[м3 О2 / м3 СН4];  [м3 О2 / м3 СО].
[м3 О2 / м3 СО].
По формуле (2.10) найдем объем кислорода для сжиганий 1 м3 горючей смеси:
 [м3 О2 / м3 горючей смеси].
[м3 О2 / м3 горючей смеси].
Полный объем кислорода, который потребуется для стехиометрической реакции горения составит
 [м3 О2].
[м3 О2].
По условию задачи объем окислительной среды, состоящей из кислорода и инертного газа и использованный для сжигания 4 м3 горючей смеси, составил 20 м3. Воспользовавшись формулой (2.13) найдем долю кислорода в окислительной среде
 .
.
Ответ:  % (объемных).
% (объемных).
Пример 1.4. Определить объём и массу воздуха, необходимого для горения 1 кг органической массы состава С – 60%, Н – 5%, О – 25%, N – 5%, W – 5%(влажность), если  , температура воздуха 305 К, давление 99,5 кПа.
, температура воздуха 305 К, давление 99,5 кПа.
Решение. Элементами, реагирующими с кислородом воздуха являются углерод и водород. Запишем для них уравнения горения: (1) 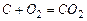 ; (2)
; (2) 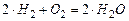 и найдем массы кислорода, который потребуется для образования стехиометрической смеси с каждым из компонентов, по формуле (2.11):
и найдем массы кислорода, который потребуется для образования стехиометрической смеси с каждым из компонентов, по формуле (2.11):
(1) 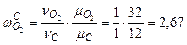 [кг О2 / кг С].
[кг О2 / кг С].
(2)  [кг О2 / кг Н2].
[кг О2 / кг Н2].
В соответствие с формулой (2.12) количество кислорода воздуха, необходимое для стехиометрического сгорания органической массы при нормальных физических условиях составит
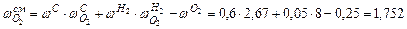
[кг О2 / кг горючей смеси]. Так полное количество органической смеси равно 1 кг, то полная масса кислорода составит  кг. Рассчитаем стехиометрическое количество воздуха по формуле (2.13):
кг. Рассчитаем стехиометрическое количество воздуха по формуле (2.13):  кг.
кг.
Фактическое количество воздуха найдем по формуле (2.5)
 кг.
кг.
Найдем объем воздуха в соответствие с заданными физическими условиями, используя (2.3)
 м3.
м3.
Ответ:  ,
, 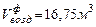 .
.
Контрольные задачи
1.1.Рассчитать объем окислительной среды 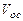 , доля кислорода в котором
, доля кислорода в котором  , для сжигания вещества
, для сжигания вещества  массой
массой 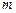 кг с коэффициентом избытка окислительной среды
кг с коэффициентом избытка окислительной среды  . Температура среды
. Температура среды  0С, а давление
0С, а давление  , кПа. Параметры для расчета, в зависимости от варианта, приведены в таблице 1.1.
, кПа. Параметры для расчета, в зависимости от варианта, приведены в таблице 1.1.
1.2.Найдите коэффициент избытка окислительной среды


