 |
Главная |
Условия химического равновесия
|
из
5.00
|
Теоретические основы 4
Условия химического равновесия 4
Факторы, влияющие на состояние равновесия 6
Расчет равновесной степени превращения 10
Порядок выполнения работы 15
Контрольные вопросы 18
Литература 19
Приложение 1 20
Приложение 2 21
ЛАБОРАТОРНАЯ РАБОТА
«ИЗУЧЕНИЕ ВЛИЯНИЯ ТЕМПЕРАТУРЫ, ДАВЛЕНИЯ И СОСТАВА ИСХОДНОЙ СМЕСИ НА РАВНОВЕСНЫЙ СОСТАВ ПРОДУКТОВ РЕАКЦИИ»
Цель:
1. Научиться устанавливать функциональную связь Кр° = F(T) и KN = F(xp)
2. Исследовать влияние различных параметров на равновесную степень превращения и равновесный состав.
3. Выбирать области изменения параметров для проведения химических исследований.
ТЕОРЕТИЧЕСКИЕ ОСНОВЫ
Условия химического равновесия
Для обратимых процессов наряду с химическим взаимодействием между исходными веществами - прямой реакцией - происходит химическое взаимодействие и между продуктами реакции, т.е. обратная реакция. По мере протекания процесса скорость прямой реакции уменьшается, а обратной увеличивается. При равенстве этих скоростей наступает химическое равновесие, неизменное при постоянстве концентрации реагентов, температуры и давления.
При изменении этих параметров равновесие нарушается, и процесс может протекать в том или ином направлении до наступления нового равновесия.
Таким образом, химическое равновесие характеризуется следующими общими условиями:
- неизменностью равновесного состава при постоянных внешних условиях;
- подвижностью равновесия;
- динамическим характером равновесия;
- возможностью подхода к равновесию с двух разных сторон.
Условием равновесия является:
 или
или 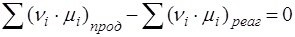 .
.
Рассмотрим реакцию:
 . (1)
. (1)
Согласно закону действующих масс:
скорость прямой реакции  ,
,
скорость обратной реакции  .
.
Здесь k1 и k2 - константы скорости прямой и обратной реакций.
В состоянии равновесия u1 = u2 или
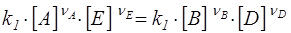 ,
,
откуда  , (2)
, (2)
где 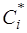 - равновесная концентрация компонента.
- равновесная концентрация компонента.
Уравнение (2) является математическим выражением закона действующих масс:
при постоянной температуре и наличии равновесия отношение произведения действующих масс продуктов реакции к произведению действующих масс исходных веществ есть величина постоянная.
Эта постоянная величина называется константой равновесия К. При вычислении К можно применять парциальные давления компонентов рi, концентрации Сi или мольные доли Ni. Соответственно получают Кр, Кс и КN.
Для реакции (1), если все компоненты находятся в газовой фазе:
 ,
,  ,
,  .
.
Следует помнить, что для реакций, протекающих с изменением числа молей, численные значения констант равновесия зависят от формы записи стехиометрического уравнения реакции. Например, реакцию окисления диоксида серы можно записать в виде:
SO2 + 0.5O2 <==> SO3
2SO2 + O2 <==> 2SO3
в первом случае  ,
,
во втором случае 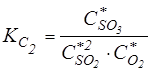 ,
,
 и
и  имеют разные размерности и
имеют разные размерности и  .
.
Аналогично для указанных реакций  ,
,  .
.
В общем случае  . Связь между ними устанавливается на основе уравнения Менделеева-Клапейрона и Дальтона.
. Связь между ними устанавливается на основе уравнения Менделеева-Клапейрона и Дальтона.
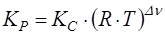 ;
;
 ; (3)
; (3)
 ,
,
где: Р – общее давление;
R – газовая постоянная;
Т – температура;
Dn = (nА + nЕ) – (nВ + nD) – изменение числа молей при протекании реакции.
Значения констант равновесия для различных реакций приведены в справочных пособиях [3, 4].
Если законы идеальных газов не выполняются, следует использовать выражение химического потенциала реального газа:

и константу равновесия, выраженную через летучести fi

|
из
5.00
|
Обсуждение в статье: Условия химического равновесия |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

