 |
Главная |
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
|
из
5.00
|
ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ (№10 – №17)
И ОРГАНИЗАЦИИ ПОДГОТОВКИ К ИХ ЗАЩИТЕ
для студентов специальностей 060800:
- экономика и управление на предприятиях лесного комплекса;
- экономика и управление в строительстве;
- экономика и управление на предприятиях природопользования
БРЯНСК 2001
МИНИСТЕРСТВО ОБРАЗОВАНИЯ РОССИЙСКОЙ ФЕДЕРАЦИИ
Брянская государственная инженерно-технологическая академия
Кафедра химии
УТВЕРЖДЕНО
Научно-методическим советом БГИТА
Протокол №___ от_____2001 г.
ХИМИЯ
МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ПО ВЫПОЛНЕНИЮ ЛАБОРАТОРНЫХ РАБОТ (№10 – №17)
И ОРГАНИЗАЦИИ ПОДГОТОВКИ К ИХ ЗАЩИТЕ
для студентов специальностей 060800:
- экономика и управление на предприятиях лесного комплекса;
- экономика и управление в строительстве;
- экономика и управление на предприятиях природопользования
БРЯНСК 2001
Составитель: к.х.н. Кулеш И.А.
Рецензент: к.х.н., доцент Щетинская О.С.
Рекомендовано учебно-методической комиссией экономического факультета
Протокол № 9 от 3 апреля 2001 г.
-3-
ЛАБОРАТОРНАЯ РАБОТА №10
ОПРЕДЕЛЕНИЕ КАЖУЩЕЙСЯ СТЕПЕНИ ДИССОЦИАЦИИ ХЛОРИДА КАЛИЯ КРИОСКОПИЧЕСКИМ МЕТОДОМ
Цель работы: экспериментальное определение кажущейся степени диссоциации сильного электролита криоскопическим методом.
Оборудование и реактивы: прибор для определения температуры замерзания жидкости (рис.1): штатив с лапкой, стакан на 50 – 100 мл, большой стакан для охладительной смеси, две мешалки с кольцами различных диаметров, термометр Бекмана, термометр с нулем в середине шкалы; мерный цилиндр, технохимические весы, фильтровальная бумага, ложка, шпатель, хлорид натрия и снег (толченый лед) для охладительной смеси, кристаллический хлорид калия, дистиллированная вода.
ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ
Степень диссоциации a есть отношение числа молекул, подвергшихся в растворе распаду на ионы, к общему числу растворенных молекул. По степени диссоциации в растворах электролиты подразделяются на сильные и слабые.
Для сильных электролитов a=1 и не зависит от концентрации раствора. К ним относятся водные растворы подавляющего числа солей, гидроксидов щелочных и щелочноземельных металлов, ряда кислот (HCl, HBr, HI, HClO4, HNO3, H2SO4, H2SeO4 и др.).
Для слабых электролитов a< 1 и уменьшается с ростом концентрации раствора. К слабым электролитам относятся водные растворы аммиака, некоторых органических азотсодержащих соединений (гидразин NH2NH2, гидроксиламин NH2OH, и др.), таких кислот, как HNO2, H3BO3, H2CO3, CH3COOH, H2SO3, HOCl, HCN, водный раствор H2S и др.).
Вследствие электролитической диссоциации, число частиц в растворе электролита будет больше, чем при растворении такого же количества неэлектролита. Это обусловливает понижение температуры замерзания раствора электролита по сравнению с раствором неэлектролита.

 , (1)
, (1)
где i – изотонический коэффициент (для электролитов больше 1), Dtоп. – понижение температуры замерзания раствора, определенное опытным путем, Dtтеор. – понижение температуры замерзания раствора, вычисленное без учета диссоциации электролита по формуле:
-4-

 , (2)
, (2)
где m1 - масса растворенного вещества в граммах, m2 – масса растворителя в граммах, М – молярная масса растворенного вещества, Кк – криоскопическая постоянная для воды, равная 1,85 К×кг/моль.
Изотонический коэффициент I связан со степенью диссоциации a соотношением
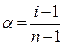 , (3)
, (3)
где n - число ионов, на которые распадается при диссоциации электролит.
С учетом (1), выражение (3) можно записать в виде
 . (4)
. (4)
Таким образом, для экспериментального определения степени диссоциации электролита нужно измерить понижение его температуры замерзания и воспользоваться формулой (4).
Следует иметь в виду, что для сильных электролитов, каким является хлорид калия, найденная таким образом степень диссоциации будет кажущейся. В действительности сильные электролиты в растворе диссоциированы полностью (a=1). Наблюдаемое отличие кажущейся степени диссоциации от единицы вызвано межионным взаимодействием в растворе сильного электролита.
Из-за полной диссоциации такого электролита концентрации ионов велики, а среднее расстояние между ними мало. Это приводит к сильному межионному взаимодействию. В растворах сильных электролитов ионы не свободны в движении. Каждый из них окружен как бы «атмосферой» из ионов противоположного знака. Поэтому свойства растворов, зависящие от концентрации ионов, будут проявляться в меньшей степени, как если бы число ионов было меньше, чем это соответствует полной диссоциации электролита.
Поскольку растворы сильных электролитов значительно отличаются по свойствам от идеальных растворов, то при расчетах следует пользоваться не концентрациями, а активностями ионов, в соответствии с которыми ионы проявляют свое действие. Активность а определяется выражением:
a=f× C,
где f – коэффициент активности ионов, зависящий от концентрации и состава раствора, заряда, природы иона, температуры и других факторов, С – концентрация ионов.
Понятие активности применимо и к электролиту в целом. Активность электролита равна произведению активностей его ионов. Для электролита АmBn активность a=a+m × a-n.
-5-
Средняя активность ионов электролита АmBn рассчитывается по формуле:  .
.
Средний коэффициент активности электролита АmBn связан с коэффициентами активности его ионов соотношением: 
 .
.
В разбавленных растворах (С не превышает 0,5моль/л) можно приближенно считать, что коэффициент активности зависит только от заряда иона и ионной силы раствора, которая вычисляется по формуле:
 ,
,
где Сi – концентрации, а zi – заряды всех находящихся в растворе ионов. В последней формуле под Сi строго следует понимать моляльность ионов, однако в разбавленных растворах, для которых справедлива эта формула, моляльность по величине мало отличается от молярности.
В разбавленных растворах коэффициент активности f мало зависит от природы растворенных веществ. Для таких растворов при 298 К приближенно средний коэффициент активности ионов электролита можно рассчитать по формуле Дебая-Гюккеля:
 ,
,  .
.
МЕТОДИКА ПРОВЕДЕНИЯ ОПЫТА
1. Заполнить стакан охладительной смесью, состоящей из трех частей снега (толченого льда) и одной части хлорида натрия. Температура охладительной смеси должна быть –3 ¾ - 5 0С. Ее можно регулировать при помощи изменения соотношения снега (льда) и соли.
 |
Рис.1. Прибор для определения температуры замерзания раствора
2. Отмерить 30 мл дистиллированной воды и влить в маленький стакан или пробирку большого диаметра.
3. Собрать прибор по рис.1.
-6-
4. Укрепить термометр так, чтобы он входил в кольцо мешалки, а ртутный шарик был полностью закрыт жидкостью.
5. Все время перемешивая воду мешалкой, определить по температуре замерзания воды нулевую точку термометра. Нужно иметь в виду, что жидкость часто переохлаждается. Поэтому температурой замерзания чистой воды следует считать ту температуру, которая устанавливается в момент замерзания после некоторого скачка вверх.
6. Вынуть маленький стакан из прибора, растопить лед и еще раз определить температуру замерзания воды.
7. Взвесить на технохимических весах 0,75 г хлорида калия, растворить его в воде, находящейся в маленьком стакане.
8. Поместить маленький стакан в прибор, установить термометр. Постоянно перемешивая раствор, определить температуру его замерзания. Под температурой замерзания следует понимать температуру начала замерзания, так как процесс замерзания раствора, в отличие от чистого растворителя, протекает при постепенно понижающейся температуре. Повторить измерение еще раз.
9. Результаты опыта представить в виде таблицы:
| Масса растворителя, г | Температура замерзания растворителя, 0С | Масса KCl, г | Температура замерзания раствора, 0С | Понижение температуры замерзания раствора Dt,0С | |
| Dtтеор. | Dtоп. | ||||
| 1. 2. Среднее значение | 1. 2. Среднее значение |
10. По формуле (2) вычислить понижение температуры замерзания раствора без учета диссоциации электролита.
11. По формуле (4) вычислить кажущуюся степень диссоциации хлорида калия. Объяснить, чем вызвано отклонение от единицы значения кажущейся степени диссоциации сильного электролита.
ПРИМЕРЫ РЕШЕНИЯ ЗАДАЧ
Пример 1
Вычислить активность серной кислоты, а также среднюю активность ее ионов в растворе концентрацией 0,01 моль/л, если средний коэффициент активности ионов равен 0,544. Считать, что серная кислота полностью диссоциирует по обеим ступеням.
Решение
Активность серной кислоты может быть вычислена по формуле:
a(H2SO4) = a2(H+) × a(SO42-) = C2(H+) × C(SO42-) × f±3.
-7-
Так как при диссоциации 1 моль серной кислоты образуется 2 моль ионов водорода и 1 моль сульфат-ионов, то при концентрации кислоты 0,01 моль/л молярная концентрация ионов водорода будет равна 0,02 моль/л, а сульфат-ионов – 0,01 моль/л.
а(H2SO4)=(0,02)2×0,01×(0,544)3=6,4×10-7 (моль/л).
Средняя активность ионов:
 .
.
Пример 2
Определить активность MgCl2 в его 0,01М растворе.
Решение
a(MgCl2) = a(Mg2+) × a2(Cl-) = C(Mg2+) × C2(Cl-) × f±3.
Так как при диссоциации 1 моль хлорида магния образуется 2 моль ионов хлора и 1 моль ионов магния, то при концентрации хлорида магния 0,01 моль/л молярная концентрация ионов хлора будет равна 0,02 моль/л, а ионов магния – 0,01 моль/л.
Рассчитаем ионную силу раствора:
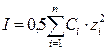 = 0,5(C(Mg2+) × 22 + C(Cl-)× (-1)2) = 0,5(0,01× 4 + 0,02) = 0,03.
= 0,5(C(Mg2+) × 22 + C(Cl-)× (-1)2) = 0,5(0,01× 4 + 0,02) = 0,03.
Средний коэффициент активности ионов приближенно найдем по уравнению Дебая-Гюккеля:
 ,
,  = - 0,5 × ç2×(- 1)ê×
= - 0,5 × ç2×(- 1)ê×  = - 0,173;
= - 0,173;
f± = 10-0,173 = 0,671
Теперь можно рассчитать активность хлорида магния:
a(MgCl2) =C(Mg2+) × C2(Cl-) × f±3 = 0,01×(0,02)2×(0,671)3 = 1,2×10-6 (моль/л).
НЕОБХОДИМЫЙ УРОВЕНЬ ПОДГОТОВКИ СТУДЕНТОВ
1. Знать понятия: электролиты и неэлектролиты, степень диссоциации, сильные и слабые электролиты (примеры), константа диссоциации слабого электролита.
2. Знать причины отклонения растворов электролитов от закона Рауля и уравнения Вант-Гоффа для осмотического давления.
3. Знать, что такое изотонический коэффициент, каковы его физический смысл и связь со степенью диссоциации электролита.
4. Знать особенности состояния ионов в растворах сильных электролитов, понятие кажущейся степени диссоциации.
5. Иметь представление об активности ионов и активности электролита, коэффициенте активности, его приближенном расчете для разбавленных растворов электролитов через ионную силу раствора.
-8-
ЗАДАНИЯ ДЛЯ САМОКОНТРОЛЯ
1. Вычислить изотонический коэффициент и кажущуюся степень диссоциации 2% - ного водного раствора хлорида натрия, если он замерзает при – 1,26 0С.
2. Вычислить активность Ba(NO3)2, а также среднюю активность его ионов в растворе, если средний коэффициент активности ионов f±=0,74, а концентрация соли в растворе составляет 0,006 моль/л.
3. Определить активность CuSO4 в водном растворе, если для приготовления раствора на 1000 г воды взяли 1,5 г CuSO4.
ЛИТЕРАТУРА
1. Курс общей химии /Под ред. Н.В.Коровина. – М.:Высш. шк., 1990. С.158 – 163.
2. Н.Л.Глинка. Общая химия. – Л.:Химия, 1983. С.223 – 234.
3. Н.Б.Любимова. Вопросы и задачи по общей и неорганической химии. – М.:Высш. шк., 1990. – С.202 – 203; 210 – 211.
4. Н.Л.Глинка. Задачи и упражнения по общей химии. – Л.:Химия. 1985. – С.123 – 126; 128 – 130.
|
из
5.00
|
Обсуждение в статье: ТЕОРЕТИЧЕСКИЕ ПОЯСНЕНИЯ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

