 |
Главная |
Константа диссоциации. Степень диссоциации
|
из
5.00
|
Принцип Ле Шателье
Принцип Ле Шателье —— если на систему, находящуюся в устойчивом равновесии, воздействовать извне, изменяя какое-либо из условий равновесия (температура, давление, концентрация, внешнее электромагнитное поле), то в системе усиливаются процессы, направленные на компенсацию внешнего воздействия.
Анри Ле Шателье сформулировал этот термодинамический принцип подвижного равновесия, позже обобщённый
Принцип применим к равновесию любой природы: механическому, тепловому, химическому, электрическому
Влияние температуры
Влияние температуры зависит от знака теплового эффекта реакции. При повышении температуры химическое равновесие смещается в направлении эндотермической реакции, при понижении температуры — в направлении экзотермической реакции. В общем же случае при изменении температуры химическое равновесие смещается в сторону процесса, знак изменения энтропии в котором совпадает со знаком изменения температуры. Зависимость константы равновесия от температуры в конденсированных системах описывается уравнением изобары Вант-Гоффа:

в системах с газовой фазой — уравнением изохоры Вант-Гоффа

В небольшом диапазоне температур в конденсированных системах связь константы равновесия с температурой выражается следующим уравнением:

Например, в реакции синтеза аммиака
N2 + 3H2 ⇄ 2NH3 + Q
тепловой эффект в стандартных условиях составляет +92 кДж/моль, реакция экзотермическая, поэтому повышение температуры приводит к смещению равновесия в сторону исходных веществ и уменьшению выхода продукта.
Влияние давления
Давление существенно влияет на положение равновесия в реакциях с участием газообразных веществ, сопровождающихся изменением объёма за счёт изменения количества вещества при переходе от исходных веществ к продуктам:
При повышении давления равновесие сдвигается в направлении, в котором уменьшается суммарное количество молей газов и наоборот.
В реакции синтеза аммиака количество газов уменьшается вдвое: N2 + 3H2 ↔ 2NH3
Значит, при повышении давления равновесие смещается в сторону образования NH3, о чём свидетельствуют следующие данные для реакции синтеза аммиака при 400 °C:
| давление, МПа | 0,1 | |||||
| объемная доля NH3, % | 0,4 |
Влияние инертных газов
Введение в реакционную смесь или образование в ходе реакции инертных газов действует так же, как и понижение давления, поскольку понижается парциальное давление реагирующих веществ. Следует отметить, что в данном случае в качестве инертного газа рассматривается газ, не участвующий в реакции. В системах с уменьшением количества молей газов инертные газы смещают равновесие в сторону исходных веществ, поэтому в производственных процессах, в которых могут образовываться или накапливаться инертные газы, требуется периодическая продувка газоводов.
Влияние концентрации
Влияние концентрации на состояние равновесия подчиняется следующим правилам:
· При повышении концентрации одного из исходных веществ равновесие сдвигается в направлении образования продуктов реакции;
· При повышении концентрации одного из продуктов реакции равновесие сдвигается в направлении образования исходных веществ.
Константа диссоциации. Степень диссоциации.
Электролитическая диссоциация — обратимый равновесный процесс. Поэтому для диссоциации, так же как и для других, можно записать выражение для константы равновесия.
В общем виде диссоциация электролита AnBm происходит по уравнению:
AnBm nAm++mBn- (1)
Следовательно, константа равновесия будет равна:
K=[Am+]n[Bn-]m/[AnBm]
где константа равновесия К называется константой диссоциации KD, [Am+], [Bn- ] и [AnBm] — соответствующие концентрации, выраженные в моль/л.
Константа диссоциации зависит только от температуры, но не зависит от концентрации раствора.
Помимо константы диссоциации, существует еще одна количественная характеристика поведения электролита в растворе.
Степень диссоциации — это отношение числа молекул, распавшихся на ионы, к общему числу растворившихся молекул.
a=n/N,
где n — число молекул, распавшихся на ионы, а N —общее число растворенных молекул. Поскольку n£N, то соответственно соответственно 0£a£1(или в процентах: 0£a£100%).
По степени диссоциации электролиты разделяются на слабые, средние и сильные.

Если значение a близко к нулю (или к 0% ), то это значит, что диссоциации нет, и такие электролиты называют слабыми. Если
a®1 (или a®100%), то говорят, что диссоциация полная, а электролит — сильный.
Сильными электролитами являются многие хорошо растворимые кислоты, имеющие молекулярное строение: серная, хлороводородная, азотная, хлорная, бромоводородная и др. Сильными электролитами являются также все ионные соединения (все соли и гидроксиды), даже если они плохо растворимы, поскольку они не могут существовать в растворе в молекулярном виде.
Слабые электролиты — это такие кислоты, как сернистая» борная, уксусная и большинство органических кислот, и вода.
Степень диссоциации, в отличие от константы диссоциации, зависит от концентрации. Чем меньше концентрация, тем выше значение а. Эта зависимость выполняется для всех электролитов (сильных и слабых), имеющих молекулярное строение. Степень диссоциации ионных электролитов от концентрации не зависит, т.к. для них всегда а = 1.
Гидролиз
Гидро́лиз (от др.-греч. ὕδωρ — вода и λύσις — разложение) — один из видов химических реакций сольволиза, где при взаимодействии веществ с водой происходит разложение исходного вещества с образованием новых соединений. Механизм гидролиза соединений различных классов: соли, углеводы, белки, сложные эфиры, жиры и др. имеет существенные различия.
Гидролиз солей
Гидролиз солей — разновидность реакций гидролиза, обусловленного протеканием реакций ионного обмена в растворах (преимущественно, водных) растворимых солей-электролитов. Движущей силой процесса является взаимодействие ионов с водой, приводящее к образованию слабого электролита в ионном или (реже) молекулярном виде («связывание ионов»).
Различают обратимый и необратимый гидролиз солей[1]:
· 1. Гидролиз соли слабой кислоты и сильного основания (гидролиз по аниону):
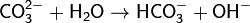
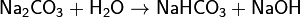
(раствор имеет слабощелочную среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 2. Гидролиз соли сильной кислоты и слабого основания (гидролиз по катиону):
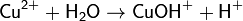

(раствор имеет слабокислую среду, реакция протекает обратимо, гидролиз по второй ступени протекает в ничтожной степени)
· 3. Гидролиз соли слабой кислоты и слабого основания:
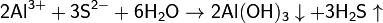

(равновесие смещено в сторону продуктов, гидролиз протекает практически полностью, так как оба продукта реакции уходят из зоны реакции в виде осадка или газа).
Соль сильной кислоты и сильного основания не подвергается гидролизу, и раствор нейтрален
Степень гидролиза
Под степенью гидролиза подразумевается отношение части соли, подвергающейся гидролизу, к общей концентрации её ионов в растворе. Обозначается α (или hгидр);
α = (cгидр/cобщ)·100 %
где cгидр — число молей гидролизованной соли, cобщ — общее число молей растворённой соли.
Степень гидролиза соли тем выше, чем слабее кислота или основание, её образующие.
Является количественной характеристикой гидролиза.
Константа гидролиза Константа гидролиза — константа равновесия гидролитической реакции. Так константа гидролиза соли равна отношению произведения равновесных концентраций продуктов реакции гидролиза к равновесной концентрации соли с учетом стехиометрических коэффициентов.
В качестве примера ниже приводится вывод уравнения константы гидролиза соли, образованной слабой кислотой и сильным основанием:


Уравнение константы равновесия для данной реакции имеет вид:
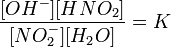 или
или 
Так как концентрация молекул воды в растворе постоянна, то произведение двух постоянных  можно заменить одной новой — константой гидролиза:
можно заменить одной новой — константой гидролиза:

Численное значение константы гидролиза получим, используя ионное произведение воды  и константу диссоциации азотистой кислоты
и константу диссоциации азотистой кислоты  :
:


подставим в уравнение константы гидролиза равна:

В общем случае для соли, образованной слабой кислотой и сильным основанием:
 , где
, где  — константа диссоциации слабой кислоты, образующейся при гидролизе
— константа диссоциации слабой кислоты, образующейся при гидролизе
для соли, образованной сильной кислотой и слабым основанием:
 , где
, где  — константа диссоциации слабого основания, образующегося при гидролизе
— константа диссоциации слабого основания, образующегося при гидролизе
для соли, образованной слабой кислотой и слабым основанием:

|
из
5.00
|
Обсуждение в статье: Константа диссоциации. Степень диссоциации |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

