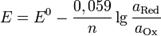Виды окислительно-восстановительных реакций
- межмолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах разных веществ, например:Н2S + Cl2 ---> S + 2HCl
- внутримолекулярные - реакции, в которых окисляющиеся и восстанавливающиеся атомы находятся в молекулах одного и того же вещества, например:NH4NO3 ---> N2O + 2 H2O
- диспропорционирование (самоокисление-самовосстановление) - реакции, в которых атомы с промежуточной степенью окисления превращаются в эквимолярную смесь атомов с более высокой и более низкой степенями окисления:Cl2 + H2O ---> HClO + HCl
Примеры Окислительно-восстановительная реакция между водородом и фтором 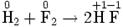
Разделяется на две полуреакции:
1) Окисление:
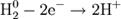
2) Восстановление:
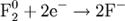
Окисление, восстановление В окислительно-восстановительных реакциях электроны от одних атомов, молекул или ионов переходят к другим. Процесс отдачи электронов — окисление. При окислении степень окисления повышается:
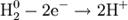
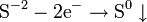
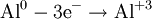
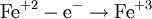
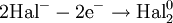
Процесс присоединения электронов — восстановление. При восстановлении степень окисления понижается:
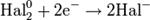
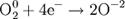
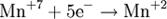
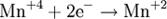
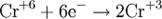
Атомы или ионы, которые в данной реакции присоединяют электроны являются окислителями, а которые отдают электроны — восстановителями. Окислительно-восстановительный потенциал (редокс-потенциал от англ. redox — reduction-oxidation reaction, Eh или Eh) — мера способности химического вещества присоединять электроны (восстанавливаться[1]). Окислительно-восстановительный потенциал выражают в милливольтах (мВ).Окислительно-восстановительный потенциал определяют как электрический потенциал, устанавливающийся при погружении платины или золота (инертный электрод) в окислительно-восстановительную среду, то есть в раствор, содержащий как восстановленное соединение (Ared), так и окисленное соединение (Aox). Если реакцию окисления-восстановления представить уравнением:Aox + n·e- → Ared то количественная зависимость окислительно-восстановительного потенциала от концентрации (точнее активностей) реагирующих веществ выражается уравнением Нернста. Окислительно-восстановительный потенциал определяют электрохимическими методами и выражают в милливольтах (мВ) относительно стандартного водородного электрода в стандартных условиях. Окислительно-восстановительный потенциал (Eh)
| | | | | В справочнике по гидрохимии на сайте методического центра "Эколайн
" дано следующее определение: "Окислительно-восстановительный потенциал (ОВП) является мерой химической активности элементов или их соединений в обратимых химических процессах, связанных с изменением заряда ионов в растворах". Значение окислительно-восстановительного потенциала для каждой окислительно-восстановительной реакции вычисляется по довольно сложной формуле, выражается в милливольтах и может иметь как положительное, так и отрицательное значение. В природной воде значение Eh колеблется от - 400 до + 700 мВ, что определяется всей совокупностью происходящих в ней окислительных и восстановительных процессов. В условиях равновесия значение ОВП определенным образом характеризует водную среду, и его величина позволяет делать некоторые общие выводы о химическом составе воды. В зависимости от значения ОВП различают несколько основных ситуаций, встречающихся в природных водах: 1. Окислительная. Характеризуется значениями Еh > + (100 - 150) мВ, присутствием в воде свободного кислорода, а также целого ряда элементов в высшей форме своей валентности (Fe3+, Mo6+, As5-, V5+, U6+, Sr4+, Cu2+, Pb2+). Ситуация, наиболее часто встречающаяся в поверхностных водах.
2. Переходная окислительно-восстановительная. Определяется величинами Еh от 0 до + 100 мВ, неустойчивым геохимическим режимом и переменным содержанием сероводорода и кислорода. В этих условиях протекает как слабое окисление, так и слабое восстановление целого ряда металлов;
3. Восстановительная. Характеризуется значениями Еh < 0. Типична для подземных вод, где присутствуют металлы низких степеней валентности (Fe2+, Mn2+, Mo4+, V4+, U4+), а также сероводород.
Окислительно-восстановительный потенциал зависит от
| |
|
| 6 Этапы хим анализа: отбор проб…Хим анализ сложных материалов состоит из след этапов:1-отбор пробы для анализа.Лаборатор проба сост-т 10-50гр материала,оторый должен быть отобран так, чтобы его ср состав соотвествовал сред сос-ву всей партии анализ-го объекта.Лаб пробу готовят по спец правилам 2-разложение пробы и переведение ее в растворы,проба растворяет в воде или обрабатывают кислотами; при необходимости материал всплавляется различными вещ-ми, озоляют или использ др способы хим воздействия на него.3-провед хим реакции.На опред компонент пробы воздействуют реагентом.В результате чего образуется продукт реакции. Этому этапу должно быть уделено основное внимание4-измерение какого либо физ-го параметра продукта реакции, реагента или самого определяемого вещ-ва.На основе этого измерения судят о количестве или о содержании определяемого компонента в анализируемом материале.
7 процесс анализа.пробоотбор,пробоподготовка,измерение9хим анализ) и обработка результатов.Пробоотбор-такая операция при которой происходит отбор достаточного количества представленной части исследуемого материала.Сос-в и св-ва которой идентичны сос-ву и св-ам материала, Как целого.Главной задачей при анализе явл-отбор средней пробы,т е небольшой части анализ материала средний сос-в и св-ва которой максимально приблежаются к сред-му сос-ву и св-ам всего исследуемого в-ва.Неправильный отбор сред пробы всегда приведет к неправильным результатам.Различают метод отбора пробы:кусковой или сыпучей массы,металлов и сплавов,пульпы и жидкостей газов.Приготовление пробы:генеральная проба(первичная проба), как и проба после сокращения должна соответствовать по содерж компонентов всей анализируемой партии материала.Для отбора этой пробы исход твердый материал-дробят,перемешивают, а затем отбирают пробы.Отбор проб из гомогенных газов и жидкостей.В этом случае можно отобрать небольшие пробы,однако, для уверенности необходимо перед отбором пробы перемешать анализируемый материал,если это не возможно, необходимо отобрать несколько проб на различной глубине.Следует иметь в виду, что содержание газов(О) водных соприкасающ с воздухом рас-ов очень сильно зависит от глубины отбора пробы и отличается в 1000раз.Промышленные газы можно анализировать по ходу потока.Отбор проб ТВ. В-ств представительную пробу ТВ в-ств можног приготовить отобрав 10,2,1 % масса анализируемого материала.Потери и загрязнения при проотборе.Требования к пробе:1 проба должна быть представлена по отношению к обьекту анализа, т.е а)гомогенной б)опред-е время отбора в)важно место отбора 2-проба не должна содержать никаких загрязнений 3-устойчивость пробы до выполнения анализа(консервирование)4-достаточное кол-во для анализа. Пробоотбор-такая операция при которой происходит отбор достаточного количества представленной части исследуемого материала.Сос-в и св-ва которой идентичны сос-ву и св-ам материала, Как целого.При отборе пробы учитывается: агрегатное состояние,размер частиц,с которых начинается неоднородность,требуемая точность оценки содержания компонента по все массе обьекта,в зависимости от задачи анализа.Потеря и загрязнение при отборе и хранении проб.: в виде пыли; потеря летучих продуктов; адсорбция опред компонента на поверхность емкостей для отбора и хранения проб; протекание хим реакции; внешнее загрязнение; хранение и консервация проб.
8 качественный и количественный анализ.Кач-ый-обнаружение эл-в или их соединений входящих в сос-в анализируемого материала.Кол-ый-нахождение количественных соотношений между компонентами найденными при качественном исследовании.Методы колич-го анализа:кислотно-основное титрование,титрование вне водных растворителях,гравиметрич-й метод,осодительное титрование,комплекснометрическое титрование,окислительно-востановит-е титрование.Кислотно-основное применяется для определения концентрации кислот и оснований,для этого к анализируемому рас-ру(кислоты,основания)добавляют рас-р реагента.(основания,кис-ты)Известной концентрацией до тех пор пока определенное вещ-во и титрант не окажутся в эквивалентных друг-другу количествах-точка эквивалентности которую можно зафиксировать по изменению окраски индикаторов или потенциометрическим методом.Комплекснометрическое титрование это метод титрования ионов металлов раст-ми этилендиаминтетраацитата(ЭДТА) или др α-аминополикарбоновых кис-т Используется реакция комплексообразования; можно определить множество суммарных показателей N-жесткость воды,обусловленную наличием ионов кальция и магния; высокая устойчивость образования комплексов большая скорость хим-х реакции, возможность образования комплексов единственного состава 1:1.Обуславливаю высокую точность результата комплекснометрического титрования;для обеспечения достаточной растворимости в качестве титранта обычно применяют динатриевую соль(ЭДТК) Na2H2I с разными ианами металлов образуются комплексы различного заряда: Cu+H2I->CuI+2H, Al+H2I->AlI +2H Окислительно-востановительное титрование- реакции окислительно-восстановительные лежат в основе многих аналит методов:разложение металлов;электрохимических методов контроль и качество воды; окислит-восстанов титрования
10Инструментальные методы.Принципы анализа основанные на физических взаимодействиях,реализуется в спектроскопических некоторых электрохим-х,хромотографических методах.Без применения необходимой аппаратуры автоматизация анализа не возможна,даже с приминением методов основанных на протекании хим реакции.Спектроскопический метод анализа-это методыоснованные на взаимодействии вещ-ва(аналогич-го образца)с электромагнитным излучением.Электромагнит-е излучение –вид энергии распростроняющийся в вакууме со скоростью 300000 км/сек.Она может выступать в форме света,теплового и ультраф.излучения,микро и радио волны,гамма и рентгеновских лучей.Инструментальные методы анализа — количественные аналитические методы, для выполнения которых требуется электрохимическая оптическая, радиохимическая и иная аппаратура. К инструментальным методам анализа обычно относят:электрохимические методы— потенциометрию, полярографию, кондуктометрию и др.;Хроматография метод разделения и анализа смеси вещ0в основанные на различном распределении их между 2-мя не смешивающимися фазами-подвижные и неподвижные.
11Обработка и представление данных обработка измеряемых велечин сигналов и преобразований их в аналитич информацию; проверка правильности результатов анализа,их оценка статистическими методами; обеспечения кач-ва результатов анализа.Качество-совокупность свойств и признаков продукта или вида деятельности,обеспечивающих его соответствие необходимым требованиям.Обеспечение кач-ва-совокупность всех мероприятий призванных гарантировать соответствие продукта или вида деятельности необходимым требованиям В не входят системы управления качеством,планирующимся кач-ва и испытания кач-ва.Дифект –несоотвествие прдукта необходимым требованиям, влияющим на его потребительские св-ва.В хим анализе продукт-результаты анализ, а дифект погрешность измерения ложные выводы
12 Аналитическая реакция и их хар-ка Внешний эффект аналит реакций :1выделение или растворение осадка 2-образование растворимого окрашенного соединения 3-выделение газа с опред св-ми(запах цвет)
13 Требования к аналит реакц. 1-реакции должны быть характерны для 1-го вещ-ва или группы вещ-в 2-наблюдаемый эффект в результате реакции должен быть ярковыражен и может быть измерен каким либо способом По характеру хим реакции :цветные,ракция осождения и раствор осадка,реакция сопровозд выдел газа Уветные реакции :
Реакция осаждения и раствор осадков.Приминение –для разделения ионов,для обнаруж ионов в кач-ом анализе.Для гравиметрического и титриметрического осодительного определения в количественном анализе,способность к осаждению зависит от:свойства катиона и аниона входящих в состав труднорастворимого соединения;Констрационных условий которые проводят реакцию осаждения; Рн раствора,темпер,ионы силы раствора,состава и содержание др вещ-в в растворе.
Проверочная реакция
Реакция сопров выдел газа
Условия обнаруж вещ-в.Предел обнаружения мин концентрация или мин кол-ва вещ-ва котрое можно определять с заданной погрешностью.Предельное разбавление:отношение 1 еденицы массы определяемого иона к массе наибольшего кол-ва растворителя выраженного в тех же еденицах.Избиратьельность характеризует способность определяемого вещ-ва реагировать в приутствии посторонних вещ-в.Реакции осаждения реакции протекающие с измен степеней окисления реагир вещ-в
14методы изуч сос-ва вещ-ва Метод разделения- наиболее распространенный метод разделения это перевод анализируемого или мешающих компонентов в другую фазу(ТВ,жидк,газообраз)Некоторые методы разделения:экстракция,хромотография,адсорбция.Химические методы анализа Гравиметрический метод анализа. Прямые и косвенные определения. Кристаллические и аморфные осадки. Схема образования осадка. Причины и виды загрязнения осадка (соосаждение, последовательное и совместное осаждение). Требования к осаждаемой и гравиметрической форме. Примеры применения гравиметрического метода анализа: определение ионов металлов и сульфид-иона; анализ фосфатов, силикатных и карбонатных пород.Титриметрические методы анализа. Способы титрования: прямое, обратное, вытеснительное, косвенное. Кислотно-основное титрование. Требования, предъявляемые к реакциям в кислотно-основном титровании. Кривые титрования, точка эквивалентности, конечная точка титрования. Индикаторы. Первичные и вторичные стандарты, рабочие растворы. Построение кривых титрования, выбор индикатора, погрешность титрования. Примеры практического применения кислотно-основного титрования - определение HCl, NaOH, Na2CO3.Комплексонометрическое титрование. Требования к реакциям комплексо-образования, применяемым в титриметрии. Применение аминополикарбоновых кислот. Металлохромные индикаторы и требования к ним. Построение кривых титрования.Окислительно-восстановительное титрование. Построение кривых титрования. Способы фиксирования конечной точки титрования в окислительно-восстановительном титровании. Методы: перманганатометрический, иодометрический, бихроматометрический.Физико-химические методы анализа Спектроскопические методы анализа. Основные характеристики электромагнитного излучения (длина волны, частота, волновое число, интенсивность). Спектры атомов. Методы атомно-эмиссионной и атомно-абсорбционной спектроскопии. Спектры молекул. Закон Бугера-Ламберта-Бера. Способы определения концентрации веществ. Спектро-фотометрический и люминесцентный методы.Электрохимические методы. Электрохимическая ячейка, индикаторный электрод и электрод сравнения. Ионометрия, потенциометрическое титрование. Кулонометрия: прямая и и кулонометрическое титрование; закон Фарадея. Классическая вольтамперометрия. Кондуктометрия: прямая и кондуктометрическое титрование, возможности поточного контроля.
18 ИОННОЕ РАВНОВЕСИЕ, равновесное состояние, существующее в растворах ЭЛЕКТРОЛИТОВ. Сильные кислоты и основы полностью распадаются на ИОНЫ в ВОДНЫХ РАСТВОРАХ, а слабые кислоты или основы только частично Сильные и слабые электролиты степень ЭД(α) α=n/N*100% α-степень ЭД-колличественная характеристика диссоциации электролита,вырважаетсяв долях эдиницы в % n-число молекул в долях единицы в % N-общ число раствор молекул Степень ЭД зависит от:концентрации,природы реакции,электролита,температ.Степень ЭД
Сильные электролиты в водных растворах диссоциируют более чем на 30 %с разбавлением раствора ассоциация увеличивается.Теория электролитической диссоциации.Эд-реакция при которой в водном растворе или расплаве электролиты распределяются на ионы.Основные положения ТЭТ1-электролиты в водном растворе диссоциируют на ионы
2 ионы ведут ся как самостоят единицы,участвующие в хим и электрохим реакциях независимо от присутствия других ионов и молекул.3-свойства ионов резко отличаются от св-в соответствующих атомов
4-в целом рас-р электронейтрален
5-в ряде случаев реакция ЭД обратима.ТЭТ постоянно развивается ей нельзя пользоваться при обьяснении реакции происходящих в неводных растворах. Константа диссоциации. Более точной характеристикой диссоциации электролита является константа диссоциации, которая от концентрации раствора не зависит.Выражение для константы диссоциации можно получить, если записать уравнение реакции диссоциации электролита АК в общем виде:A K A + K+.Поскольку диссоциация является обратимым равновесным процессом, то к этой реакцииприменим закон действующих масс, и можно определить константу равновесия как 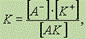 где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции  означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди[Cu2+] намного больше, чем квадрат концентрации ионов серебра[Ag+]2.Напротив, низкое значение К в реакции означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди[Cu2+] намного больше, чем квадрат концентрации ионов серебра[Ag+]2.Напротив, низкое значение К в реакции 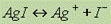 говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.Обратите особое внимание на форму записи выражений для константы равновесия.Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия(такие константы обозначаются К1).Так, для реакции меди с серебром неправильным будет выражение говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.Обратите особое внимание на форму записи выражений для константы равновесия.Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия(такие константы обозначаются К1).Так, для реакции меди с серебром неправильным будет выражение 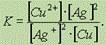 Правильной будет следующая форма записи:
Правильной будет следующая форма записи: 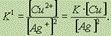 Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:АaВb <––> aАx- + bВy+ Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей: H3PO4 Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:АaВb <––> aАx- + bВy+ Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей: H3PO4  H+ + H2PO4− (α = 23,5%) H2PO4− H+ + H2PO4− (α = 23,5%) H2PO4−  H+ + HPO42− (α = 3 · 10−4%) HPO42− H+ + HPO42− (α = 3 · 10−4%) HPO42− 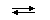 H+ + PO43− (α = 2 · 10−9%)Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. Для иллюстрации приводим таблицу зависимости продолжительности жизни типичных микроорганизмов от величины редокс-потенциала. Уравнение Нернста — уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.Вывод уравнения Нернста H+ + PO43− (α = 2 · 10−9%)Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. Для иллюстрации приводим таблицу зависимости продолжительности жизни типичных микроорганизмов от величины редокс-потенциала. Уравнение Нернста — уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.Вывод уравнения Нернста 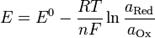 где где 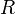 — универсальная газовая постоянная, равная 8.31 Дж/(моль*K); — универсальная газовая постоянная, равная 8.31 Дж/(моль*K); 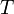 — абсолютная температура; — абсолютная температура; 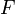 — число Фарадея, равное 96485,35 Кл/моль; — число Фарадея, равное 96485,35 Кл/моль; 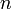 — число молей электронов, участвующих в процессе; — число молей электронов, участвующих в процессе;
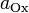 и и 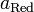 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим 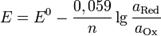
|

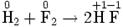
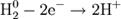
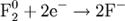
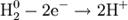
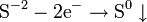
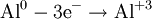
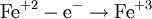
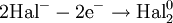
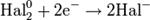
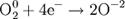
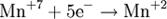
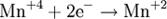
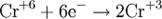
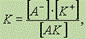 где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции
где К — константа диссоциации, которая зависит от температуры и природы электролита и растворителя, но не зависит от концентрации электролита.Диапазон констант равновесия для разных реакций очень большой — от 10-16 до 1015. Например, высокое значение К для реакции  означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди[Cu2+] намного больше, чем квадрат концентрации ионов серебра[Ag+]2.Напротив, низкое значение К в реакции
означает, что если в раствор, содержащий ионы серебра Ag+, внести металлическую медь, то в момент достижения равновесия концентрация ионов меди[Cu2+] намного больше, чем квадрат концентрации ионов серебра[Ag+]2.Напротив, низкое значение К в реакции 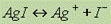 говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.Обратите особое внимание на форму записи выражений для константы равновесия.Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия(такие константы обозначаются К1).Так, для реакции меди с серебром неправильным будет выражение
говорит о том, что к моменту достижения равновесия растворилось ничтожно малое количество иодида серебра AgI.Обратите особое внимание на форму записи выражений для константы равновесия.Если концентрации некоторых реагентов существенно не изменяются в процессе реакции, то они не записываются в выражение для константы равновесия(такие константы обозначаются К1).Так, для реакции меди с серебром неправильным будет выражение 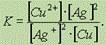 Правильной будет следующая форма записи:
Правильной будет следующая форма записи: 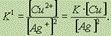 Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:АaВb <––> aАx- + bВy+ Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей: H3PO4
Это объясняется тем, что концентрации металлических меди и серебра введены в константу равновесия. Концентрации меди и серебра определяются их плотностью и не могут быть изменены. Поэтому эти концентрации нет смысла учитывать при расчете константы равновесия.Аналогично объясняются выражения констант равновесия при растворении AgCl и AgI. Процесс диссоциации слабых электролитов является обратимым и в системе существует динамическое равновесие, которое может быть описано константой равновесия, выраженной через концентрации образующихся ионов и непродиссоциировавших молекул, называемой константой диссоциации. Для некоторого электролита, распадающегося в растворе на ионы в соответствии с уравнением:АaВb <––> aАx- + bВy+ Для слабых электролитов степень диссоциации (отношение молярной концентрации продиссоциировавшего вещества cд к общей концентрации вещества cB в растворе): α = cд / cB всегда меньше единицы, но больше нуля (0 < α < 1). В случае слабых кислот состава HnA степень диссоциации по каждой следующей ступени резко уменьшается по сравнению с предыдущей: H3PO4  H+ + H2PO4− (α = 23,5%) H2PO4−
H+ + H2PO4− (α = 23,5%) H2PO4−  H+ + HPO42− (α = 3 · 10−4%) HPO42−
H+ + HPO42− (α = 3 · 10−4%) HPO42− 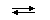 H+ + PO43− (α = 2 · 10−9%)Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. Для иллюстрации приводим таблицу зависимости продолжительности жизни типичных микроорганизмов от величины редокс-потенциала. Уравнение Нернста — уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.Вывод уравнения Нернста
H+ + PO43− (α = 2 · 10−9%)Причина этого состоит в том, что в соответствии с принципом Ле-Шателье происходит смещение химического равновесия в каждой последующей стадии диссоциации под действием катионов водорода, образовавшихся в результате диссоциации в каждой предыдущей стадии.Степень диссоциации α зависит от природы и концентрации электролита, а также от температуры раствора. Так, α растет при нагревании (поскольку диссоциации - процесс эндотермический, нагревание смещает равновесие вправо, в сторону продуктов диссоциации). При уменьшении концентрации вещества в растворе (то есть при разбавлении) степень диссоциации также увеличивается.
температуры и взаимосвязан с рН. В некоторых применениях (например, в обработке воды для бассейнов) ОВП является одним из основных параметров контроля качества воды. В частности потому, что позволяет оценить эффективность обеззараживания воды. Для иллюстрации приводим таблицу зависимости продолжительности жизни типичных микроорганизмов от величины редокс-потенциала. Уравнение Нернста — уравнение связывающее окислительно-восстановительный потенциал системы с активностями веществ, входящих в электрохимическое уравнение, и стандартными потенциалами окислительно-восстановительных пар.Вывод уравнения Нернста 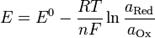 где
где 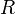 — универсальная газовая постоянная, равная 8.31 Дж/(моль*K);
— универсальная газовая постоянная, равная 8.31 Дж/(моль*K); 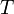 — абсолютная температура;
— абсолютная температура; 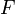 — число Фарадея, равное 96485,35 Кл/моль;
— число Фарадея, равное 96485,35 Кл/моль; 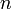 — число молей электронов, участвующих в процессе;
— число молей электронов, участвующих в процессе;
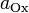 и
и 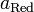 — активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим
— активности соответственно окисленной и восстановленной форм вещества, участвующего в полуреакции.Если в формулу Нернста подставить числовые значения констант R и F и перейти от натуральных логарифмов к десятичным, то при T = 298K получим