 |
Главная |
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
|
из
5.00
|
КОМПЛЕКСОНОМЕТРИЯ
Формула ЭДТА (трилона Б)– Na2C10H14N2O8·2H2O.
1. В каком объеме раствора содержится mг ЭДТА, если молярная концентрация раствора равна смоль/л?
Решение.
 ,
,
где с – молярная концентрация раствора ЭДТА, моль/л; n – количество вещества ЭДТА в растворе, моль; m – физическая масса ЭДТА в растворе, г; 1000 мл/л – пересчетный коэффициент; V – искомый объем раствора, мл; M – молярная масса ЭДТА, г/моль.
2. На титрование V1мл раствора вещества В израсходовано V2мл с М раствора ЭДТА. Найти массово-объемную концентрацию вещества В (г/л) в исследуемом растворе.
Решение.
 ,
,
где с(B) – молярная концентрация вещества В, моль/л; с – молярная концентрация раствора титранта, моль/л; V1 – объем исходного раствора вещества В, мл; V2 – объем раствора титранта, мл.
 ,
,
где ρ – искомая массово-объемная концентрацию вещества В в исследуемом растворе, г/л; M – молярная масса вещества В, г/моль.
3. К раствору вещества В добавили аммиачный буферный раствор и V1 мл с1М раствора ЭДТА. Избыток ЭДТА оттитровали V2мл с2М раствором второго титранта. Найти массу вещества В в исследуемом растворе.
Решение.
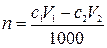 ,
,
где n – количество вещества В в растворе, моль; с1– молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2– молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл;1000 мл/л – пересчетный коэффициент.

где m – искомая физическая масса вещества В в исследуемом растворе, г; M – молярная масса вещества В, г/моль.
4. Какую массу x-гидрата вещества В, содержащего ω% индифферентных примесей, следует взять для анализа, чтобы на титрование ее потребовалось V мл с М ЭДТА?
Решение.
 ,
,
где  – количество вещества чистого x-гидрата В, моль; n(В) – количество вещества В, моль; с – молярная концентрация раствора ЭДТА, моль/л; V – объем раствора ЭДТА, мл; 1000 мл/л – пересчетный коэффициент.
– количество вещества чистого x-гидрата В, моль; n(В) – количество вещества В, моль; с – молярная концентрация раствора ЭДТА, моль/л; V – объем раствора ЭДТА, мл; 1000 мл/л – пересчетный коэффициент.
 ,
,
где  – физическая масса чистого x-гидрата В, г; M – молярная масса вещества В, г/моль; x – число молекул воды в формульной единице гидрата; M (H2O) – молярная масса воды, г/моль.
– физическая масса чистого x-гидрата В, г; M – молярная масса вещества В, г/моль; x – число молекул воды в формульной единице гидрата; M (H2O) – молярная масса воды, г/моль.
 ,
,
где m – искомая физическая масса x-гидрата В, содержащего индифферентные примеси, г; ω – массовая доля индифферентных примесей, %; 100% – пересчетный коэффициент.
5. Какая масса А-ионов содержится в пробе, если после прибавления V1 мл с1М раствора первого титранта избыток его был оттитрован V2мл с2М раствором ЭДТА?
Решение.
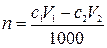 ,
,
где n – количество вещества А-ионов в пробе, моль; с1– молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2– молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл;1000 мл/л – пересчетный коэффициент.

где m – искомая физическая масса А-ионов в пробе, г; M – молярная масса А-ионов, г/моль.
6. Растворением навески В·xH2O массой m г приготовили V мл раствора, к V0 мл которого прибавили V1 мл с1М раствора ЭДТА. На титрование избытка ЭДТА израсходовали V2 мл с2М раствора второго титранта. Вычислить массовую долю (%) вещества В в образце, определить число молекул воды xв формульной единице кристаллогидрата.
Решение.
 ,
,
где n(В) – количество вещества В в образце, моль; с1– молярная концентрация раствора ЭДТА, моль/л; V1 – объем раствора ЭДТА, мл; с2– молярная концентрация раствора второго титранта, моль/л; V2 – объем раствора второго титранта, мл; V – объем исходного раствора образца, мл;1000 мл/л – пересчетный коэффициент; V0 – объем оттитрованного исходного раствора образца, мл.
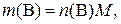
где  – физическая масса вещества В в образце, г; M – молярная масса вещества В, г/моль.
– физическая масса вещества В в образце, г; M – молярная масса вещества В, г/моль.
 ,
,
где ω – искомая массовая доля вещества В в образце, %; m – физическая масса навески, г.
 ,
,
где  – молярная масса В·xH2O, г/моль; M (H2O) – молярная масса воды, г/моль; x – искомое число молекул воды в формульной единице кристаллогидрата.
– молярная масса В·xH2O, г/моль; M (H2O) – молярная масса воды, г/моль; x – искомое число молекул воды в формульной единице кристаллогидрата.
7. Из навески карбонатной породы, содержащей соли двух металлов, массой m г получили V мл раствора. На титрование V0 мл этого раствора пошло V1 мл с1М раствора трилона Б. На титрование  мл того же раствора после отделения первого металла расходуется V2 мл с2н. раствора трилона Б. Найти массовые доли оксидов обоих металлов в карбонатной породе.
мл того же раствора после отделения первого металла расходуется V2 мл с2н. раствора трилона Б. Найти массовые доли оксидов обоих металлов в карбонатной породе.
Решение.
 ,
,
где n2 – количество вещества оксида второго металла в навеске карбонатной породы, моль; с,2– молярная концентрация раствора трилона Б во втором титровании, моль/л; V2 – объем раствора трилона Б во втором титровании, мл; V – объем раствора навески, мл; 1000 мл/л – пересчетный коэффициент;  – объем раствора навески после отделения первого металла во втором титровании, мл.
– объем раствора навески после отделения первого металла во втором титровании, мл.
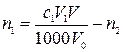 ,
,
где n1 – количество вещества оксида первого металла в навеске карбонатной породы, моль; с,1– молярная концентрация раствора трилона Б в первом титровании, моль/л; V1 – объем раствора трилона Б в первом титровании, мл; V0 – объем раствора навески в первом титровании, мл.

где m1 и m2 – физические массы оксидов первого и второго металлов соответственно в навеске, г; M1 и M2– молярные массы оксидов первого и второго металлов соответственно, г/моль.
 ,
,
где ω1 и ω2 – искомые массовые доли оксидов первого и второго металлов соответственно в карбонатной породе, %; m – физическая масса навески карбонатной породы, г.
8. На титрование пробы (V мл) анализируемого раствора, содержащего соли двух металлов, затрачено V1 мл с титром T г/мл. После полного осаждения катионов первого металла из такой же пробы раствора (V мл) избытком раствора осадителя и отфильтровывания осадка фильтрат оттитровали V2 мл такого же раствора ЭДТА. Написать уравнения всех проведенных при анализе реакций. Найти массу каждой соли (г) в пробе анализируемого раствора.
Решение.
 ,
,
где с – молярная концентрация раствора ЭДТА, ммоль/л; T – титр раствора ЭДТА, г/мл; M – молярная масса ЭДТА, г/моль.
 ,
,
где m1 – искомая физическая масса соли первого металла в пробе, моль; V1 – объем раствора ЭДТА в первом титровании, мл; V2 – объем раствора ЭДТА во втором титровании, мл; M1– молярная масса соли первого металла, г/моль.
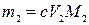 ,
,
где m1 – искомая физическая масса соли второго металла в пробе, моль; M2– молярная масса соли второго металла, г/моль.
ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ
1. Рассчитать молярные массы эквивалентов вещества В в а) кислой; б) нейтральной; в) щелочной среде.
Решение.
Ионно-электронные уравнения полуреакций:
а) MnO  + 8 H+ + 5 e– = Mn2+ + 4 H2O;
+ 8 H+ + 5 e– = Mn2+ + 4 H2O;
б) MnO  + 2 H2O + 3 e– = MnO2↓ + 4 OH–;
+ 2 H2O + 3 e– = MnO2↓ + 4 OH–;
в) MnO  + e– = MnO
+ e– = MnO  .
.
 ,
,
где  – искомая молярная масса эквивалентов вещества В, г/моль; fэк – фактор эквивалентности вещества В;
– искомая молярная масса эквивалентов вещества В, г/моль; fэк – фактор эквивалентности вещества В; 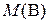 – молярная масса вещества В, г/моль.
– молярная масса вещества В, г/моль.
2. m г x-гидрата вещества В растворили в мерной колбе на V мл. На титрование V1 мл этого раствора расходуется V2 мл раствора титранта. Найти: а) молярную концентрацию эквивалентов раствора титранта; б) титр раствора титранта; в) титр раствора титранта по другому веществу.
Решение.
Ионно-электронные уравнения полуреакций:
MnO  + 8 H+ + 5 e– = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e– = Н2С2O4;
+ 8 H+ + 5 e– = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e– = Н2С2O4;
Fe3+ + e– = Fe2+.
а)  ,
,
где сэк,1 – молярная концентрация эквивалентов раствора вещества В, моль/л; 1000 мл/л – пересчетный коэффициент; m – физическая масса x-гидрата вещества В, г; V – объем исходного раствора вещества В, мл; M1 – молярная масса вещества В, г/моль; M (H2O) – молярная масса воды, г/моль; x –число молекул воды в формульной единице кристаллогидрата;  – фактор эквивалентности вещества В.
– фактор эквивалентности вещества В.
 ,
,
где сэк,2 – искомая молярная концентрация эквивалентов вещества В, моль/л; V1 – объем исходного раствора x-гидрата вещества В, пошедший на титрование, мл; V2 – объем раствора титранта, пошедший на титрование, мл.
б)  ,
,
где Т – искомый титр раствора титранта, г/мл; fэк,2 – фактор эквивалентности титранта; M2– молярная масса титранта, г/моль.
в)  ,
,
где  – искомый титр раствора титранта по другому веществу, г/мл; fэк,3 – фактор эквивалентности другого вещества; M3– молярная масса другого вещества, г/моль.
– искомый титр раствора титранта по другому веществу, г/мл; fэк,3 – фактор эквивалентности другого вещества; M3– молярная масса другого вещества, г/моль.
3. Какую навеску вещества В требуется взять, чтобы на титрование ее было затрачено V мл сэк н. раствора титранта?
Решение.
Ионно-электронное уравнение полуреакции: 2 CO2 + 2 e– =  .
.
 ,
,
где m – искомая физическая масса вещества В, г; сэк – молярная концентрация эквивалентов раствора титранта, моль/л; V – объем раствора титранта, мл; M – молярная масса вещества В, г/моль; 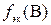 – фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент.
– фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент.
4. m г раствора вещества В разбавили водой в мерной колбе на V мл. На титрование V1 мл этого раствора расходуется V2 мл сэк н. раствора титранта. Какова массовая доля (%) вещества В в исходном растворе?
Решение.
Ионно-электронное уравнение полуреакции: O2 + 2 H+ + 2 e– = H2O2.
 ,
,
где m(В) – физическая масса вещества В в исходном растворе, г; сэк – молярная концентрация эквивалентов раствора титранта, моль/л; V2 – объем раствора титранта, мл; V – объем разбавленного исходного раствора, мл; M – молярная масса вещества В, г/моль; fэк – фактор эквивалентности вещества В;1000 мл/л – пересчетный коэффициент; V1 – объем разбавленного исходного раствора, пошедший на титрование, мл.
 ,
,
где ω – искомая массовая доля вещества В в исходном растворе, %; m – физическая масса исходного раствора, г.
5. Навеска m г руды, содержащей оксид ЭOz, обработана избытком смеси растворов веществ В и C. Раствора вещества В было взято V1 мл, и на титрование его избытка израсходовано V2 мл сэкн. раствора титранта. Найти массовую долю (%) элемента Э в руде, если известно, что на титрование V3 мл такого же раствора вещества В расходуется V4 мл раствора такого же раствора титранта.
Решение.
Ионно-электронное уравнение полуреакции:
MnO2 + 4 H+ + 2 e– = Mn2+ + 2 H2O.
 ,
,
где сэк(В) – молярная концентрация эквивалентов раствора вещества В, моль/л; V4 – объем раствора титранта, пошедший на титрование V3 мл раствора вещества В, мл.
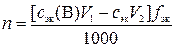 ,
,
где n – количество вещества оксида ЭOz, моль; V1 – объем раствора вещества В, взятый для обработки навески руды, мл; сэк – молярная концентрация эквивалентов раствора титранта, моль/л; V2 – объем раствора титранта, пошедший на титрование избытка раствора вещества В, мл; fэк – фактор эквивалентности оксида ЭOz; 1000 мл/л – пересчетный коэффициент.

где m(Э) – физическая масса элемента Э в навеске руды, г; M – молярная масса элемента Э, г/моль.
 ,
,
где ω – искомая массовая доля элемента Э в руде, %; m – физическая масса навески руды, г.
6. Вычислить окислительно-восстановительный потенциал системы ОФ, H+/ВФ при [ОФ] = [ВФ] и концентрации ионов водорода, равной [H+] моль/л.
Решение.

Согласно уравнению Нернста при комнатной температуре для полуреакции, ионно-электронное уравнение которой
ОФ + a H+ + z e– = ВФ + b H2O,
где ОФ и ВФ – формулы окисленной и восстановленной форм соответственно; a, z и b – коэффициенты; справедливо следующее

где e – искомый окислительно-восстановительный потенциал системы ОФ, H+/ВФ, В; e0 – стандартный окислительно-восстановительный потенциал системы ОФ, H+/ВФ, В; [ОФ], [ВФ] и [H+] – молярные концентрации соответствующих частиц в системе, моль/л.
7. К V0 мл исходного раствора соли элемента Э прибавили V1 мл сэк,1 н. раствора осадителя, затем отделили образовавшийся осадок другой соли элемента Э. На титрование оставшегося в избытке раствора осадителя было израсходовано V2мл сэк,2 н. раствора титранта. Сколько граммов элемента Э содержится в V мл исходного раствора?
Решение.
 ,
,
где n – количество вещества элемента Э в V0 мл исходного раствора, моль; сэк,1 – молярная концентрация эквивалентов раствора осадителя, моль/л; V1 – объем раствора осадителя, мл; сэк,2 – молярная концентрация эквивалентов раствора титранта, моль; V2 – объем раствора титранта, мл; fэк – фактор эквивалентности соли элемента Э; 1000 мл/л – пересчетный коэффициент.
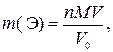
где  – искомая физическая масса элемента Э в V мл исходного раствора, г; M – молярная масса элемента Э, г/моль; V0 – объем исходного раствора, обработанный осадителем, мл.
– искомая физическая масса элемента Э в V мл исходного раствора, г; M – молярная масса элемента Э, г/моль; V0 – объем исходного раствора, обработанный осадителем, мл.
8. Сколько граммов x-гидрата вещества В следует взять для приготовления: 1) V1 мл сэк н. раствора; 2) V2 мл раствора с титром по другому веществу T г/мл?
Решение.
Ионно-электронные уравнения полуреакций:
2 SO3S2– + 2 e– = 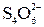 ;I2 + 2 e– = 2 I–.
;I2 + 2 e– = 2 I–.
1)  ,
,
где m1 – искомая физическая масса x-гидрата вещества В, необходимая для приготовления первого раствора, г; сэк – молярная концентрация эквивалентов первого раствора вещества В, моль/л; V1 – объем первого раствора вещества В, мл; M1 – молярная масса вещества В, г/моль; M (H2O) – молярная масса воды, г/моль; x – число молекул воды в формульной единице кристаллогидрата;  – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
– фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
2) m2 = TV2,
где m2 – физическая масса другого вещества, г; T – титр второго раствора по другому веществу, г/мл; V2 – объем второго раствора вещества В, мл.
 ,
,
где nэк,2 – количество вещества эквивалентов вещества В во втором растворе, моль; M2 – молярная масса другого вещества, г/моль;  – фактор эквивалентности другого вещества.
– фактор эквивалентности другого вещества.
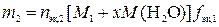 ,
,
где m2 – искомая физическая масса x-гидрата вещества В, необходимая для приготовления второго раствора.
9. Вычислить молярную концентрацию эквивалентов раствора титранта, если на титрование m г вещества В израсходовано V мл этого раствора.
Решение.
Ионно-электронное уравнение полуреакции:
2 H3AsO4 + 4 H+ + 4 e– = As2O3 + 5 H2O.
 ,
,
где сэк – искомая молярная концентрация эквивалентов раствора титранта, моль/л; 1000 мл/л – пересчетный коэффициент; M – молярная масса вещества В, г/моль; fэк – фактор эквивалентности вещества В; V – объем раствора титранта, мл.
10. К кислому раствору вещества В прибавили V1мл сэк,1 н. раствора первого титранта и выделившееся вещество оттитровали V2 мл раствора второго титранта. Найти молярную концентрацию эквивалентов раствора второго титранта.
Решение.
 ,
,
где cэк,2 – искомая молярная концентрация эквивалентов раствора второго титранта, моль/л; cэк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V1 – объем раствора первого титранта, мл; V2 – объем раствора второго титранта, мл.
11. К раствору вещества В добавили избыток раствора первого титранта и выделившееся вещество оттитровали V мл сэк н. раствора второго титранта. Сколько граммов вещества В содержалось в растворе?
Решение.
Ионно-электронное уравнение полуреакции:
 + 14 H+ + 6 e– = 2 Cr3+ + 7 H2O.
+ 14 H+ + 6 e– = 2 Cr3+ + 7 H2O.
 ,
,
где m – искомая физическая масса вещества В, г; сэк –молярная концентрация эквивалентов раствора второго титранта, моль/л; V – объем раствора второго титранта, мл; M – молярная масса вещества В, г/моль; fэк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
12. К V0мл раствора вещества В прибавлено V1 мл сэк,1 н. раствора первого титранта, избыток которого затем оттитровали V2 мл сэк,2 н. раствора второго титранта. Найти массовую долю (%) вещества В в растворе, если плотность этого раствора равна ρ г/см3.
Решение.
Ионно-электронное уравнение полуреакции:
ClO 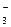 + 6 H+ + 6 e– = Cl– + 3 H2O.
+ 6 H+ + 6 e– = Cl– + 3 H2O.
 ,
,
где m – физическая масса вещества В в растворе, г; сэк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V1 – объем раствора первого титранта, мл; сэк,2 – молярная концентрация эквивалентов раствора второго титранта, моль; V2 – объем раствора второго титранта, мл; M – молярная масса вещества В, г/моль; fэк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
 ,
,
где ω – искомая массовая доля вещества В в растворе, %;V0 – объем раствора вещества В, мл; ρ – плотность раствора вещества В, г/см3.
13. При сожжении навески m г вещества В элемент Э переведен в оксид ЭOz, который поглотили раствором вещества А и сразу оттитровали V1 мл раствора первого титранта. Концентрация раствора первого титранта установлена с помощью с2 М раствора второго титранта, причем V2/V1 = y. Вычислить массовую долю (%) элемента Э в веществе В.
Решение.
Ионно-электронные уравнения полуреакций:
SO  + 4 H+ + 2 e– = SO2 + 2 H2O; 2 SO3S2– + 2 e– =
+ 4 H+ + 2 e– = SO2 + 2 H2O; 2 SO3S2– + 2 e– = 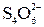 .
.
 ,
,
где n – количество вещества оксида ЭOz, моль; c2 – молярная концентрация эквивалентов раствора второго титранта, моль/л; y – отношение объемов растворов второго и первого титрантов; V1 – объем раствора первого титранта, мл;  – фактор эквивалентностиоксида ЭOz; 1000 мл/л – пересчетный коэффициент; fэк – фактор эквивалентности второго титранта.
– фактор эквивалентностиоксида ЭOz; 1000 мл/л – пересчетный коэффициент; fэк – фактор эквивалентности второго титранта.
 ,
,
где ω – искомая массовая доля элемента Э в веществе В, %;M – молярная масса элемента Э, г/моль; m – физическая масса вещества В, г.
14. Из сплава, содержащего элемент Э, последний перевели рядом операций в осадок В. Действием на этот осадок кислоты и некоторого вещества было выделено другое вещество, на титрование которого пошло V мл с М раствора титранта. Найти массу элемента Э в навеске сплава.
Решение.
Ионно-электронные уравнения полуреакций:
PbCrO4 + 8 H+ + 3 e– = Pb2+ + Cr3+ + 4 H2O; 2 SO3S2– + 2 e– = 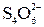 .
.
 ,
,
где n – количество вещества осадка В, моль; c – молярная концентрация э раствора титранта, моль/л; V – объем раствора титранта, мл; fэк,1 – фактор эквивалентности осадка В; 1000 мл/л – пересчетный коэффициент; fэк,2 – фактор эквивалентности титранта.

где m – искомая физическая масса элемента Э в навеске сплава, г; M – молярная масса элемента Э, г/моль.
15. К смеси, содержащей избыток иодида и иодата калия, добавили V1 мл раствора серной кислоты. Выделившийся дииод оттитровали V2 мл с М раствора титранта. Вычислить титр серной кислоты по другому веществу.
Решение.
Ионно-электронные уравнения полуреакций:
I2 + 2 e– = 2 I–; 2 SO3S2– + 2 e– = 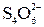 .
.
 ,
,
где n – количество вещества дииода, моль; c – молярная концентрация раствора титранта, моль/л; V – объем раствора титранта, мл; fэк,1 – фактор эквивалентности дииода; 1000 мл/л – пересчетный коэффициент; fэк,2 – фактор эквивалентности титранта.
Молекулярное уравнение реакции:
KIO3 + 3 H2SO4 + 5 KI = 3 I2 + 3 K2SO4 + 3 H2O.
Как видно из него, количества вещества дииода и серной кислоты совпадают, откуда
 ,
,
где  – искомый титр раствора серной кислоты по другому веществу, г/мл; M – молярная масса другого вещества, г/моль;
– искомый титр раствора серной кислоты по другому веществу, г/мл; M – молярная масса другого вещества, г/моль;  – фактор эквивалентности другого вещества; V1 – объем раствора серной кислоты, мл; fэк – фактор эквивалентности серной кислоты.
– фактор эквивалентности другого вещества; V1 – объем раствора серной кислоты, мл; fэк – фактор эквивалентности серной кислоты.
16. К раствору, содержащему m0 г технического вещества В прилили V1 мл сэк,1 н. раствора, избыток которого оттитровали V2 см3 сэк,2 н. раствора второго титранта. Вычислите массовую долю (%) вещества В в образце.
Решение.
Ионно-электронное уравнение полуреакции:
ClO 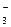 + 6 H+ + 6 e– = Cl– + 3 H2O.
+ 6 H+ + 6 e– = Cl– + 3 H2O.
 ,
,
где m – физическая масса вещества В в образце, г; сэк,1 – молярная концентрация эквивалентов раствора первого титранта, моль/л; V1 – объем раствора первого титранта, мл; сэк,2 – молярная концентрация эквивалентов раствора второго титранта, моль; V2 – объем раствора второго титранта, см3; M – молярная масса вещества В, г/моль; fэк – фактор эквивалентности вещества В; 1000 мл/л – пересчетный коэффициент.
 ,
,
где ω – искомая массовая доля вещества В в образце, %;m0 – физическая масса образца, г.
17. К V мл раствора вещества В добавили V1 мл раствора первого титранта с титром T1 г/мл (избыток). Выпавший осадок отфильтровали, и избыток первого титранта в фильтрате оттитровали V2мл раствора второго титранта с титром T2 г/мл. Определите титр исходного раствора и его молярную концентрацию.
Решение.
Ионно-электронные уравнения полуреакций:
MnO  + 8 H+ + 5 e– = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e– = Н2С2O4;
+ 8 H+ + 5 e– = Mn2+ + 4 H2O; 2 CO2 + 2 H+ + 2 e– = Н2С2O4;
 ,
,
где сэк,1 – молярная концентрация эквивалентов раствора первого титранта, ммоль/л; T1 – титр раствора первого титранта, г/мл; fэк,1 – фактор эквивалентности первого титранта; M1– молярная масса первого титранта, г/моль.
 ,
,
где сэк,2 – молярная концентрация эквивалентов раствора второго титранта, ммоль/л; T2 – титр раствора второго титранта, г/мл; fэк,2 – фактор эквивалентности второго титранта; M2– молярная масса второго титранта, г/моль.
 ,
,
где n – количество вещества В, моль; V1 – объем раствора первого титранта, мл; V2 – объем раствора второго титранта, мл; fэк – фактор эквивалентности вещества В.
 ,
,
где T – искомый титр исходного раствора, г/мл; M – молярная масса вещества В, г/моль; V – объем исходного раствора, мл.
 ,
,
где c – искомая молярная концентрация исходного раствора, моль/л; 1000 мл/л – пересчетный коэффициент.
ЭЛЕКТРОЛИЗ
1. Если годовой объем очищаемой воды равен V м3, а содержание в нем ионов Mz+ составляет ρ мг/дм3, то время, необходимое для выделения всего металла М электролизом при силе тока I А и выходе по току η%, составит ___ суток.
Решение.
 ,
,
где m – физическая масса металла М в годовом объеме очищаемой воды, г; V – годовой объем очищаемой воды, м3; ρ – концентрация ионов Mx+ в очищаемой воде, мг/дм3.
Согласно объединенному закону Фарадея
 , откуда
, откуда 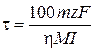
где h – выход по току, %; М – молярная масса металла М, г/моль; I – сила тока электролиза, А; t – время электролиза, с; 100% – пересчетный коэффициент; z – величина заряда катиона Mz+; F = 96 500 Кл/моль – постоянная Фарадея.
 ,
,
где  – искомое время электролиза, сутки; 86400 с/сутки – пересчетный коэффициент.
– искомое время электролиза, сутки; 86400 с/сутки – пересчетный коэффициент.
2. Масса металла М, полученного электролизом раствора соли этого металла, в течение tмин при силе тока I А и выходе по току η %, равна ___ г.
Решение.
Согласно объединенному закону Фарадея
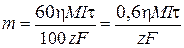 ,
,
где m – искомая физическая масса металла М, полученного электролизом раствора, г; 60 с/мин – пересчетный коэффициент; h – выход по току, %; М – молярная масса металла М, г/моль; I – сила тока электролиза, А; t – время электролиза, с; 100% – пересчетный коэффициент; z – степень окисления металла M в соли; F = 96 500 Кл/моль – постоянная Фарадея.
Методы осаждения
3. Если годовой объем очищаемой воды равен V м3, а содержание в нем ионов Mz+ составляет ρ мг/дм3, то с учетом ω%-го избытка реагента, необходимого для полного осаждения, расход щелочи  составит __ кг в год.
составит __ кг в год.
Решение.
 ,
,
где n1 – количество вещества металла М в годовом объеме очищаемой воды, моль; V – годовой объем очищаемой воды, м3; ρ – концентрация ионов Mx+ в очищаемой воде, мг/дм3; М1 – молярная масса металла М, г/моль.
Краткое ионное уравнение реакции:
Mz+ + z OH– = M(OH)z↓.
Уравнение диссоциации щелочи:
 .
.
Из них видно, что
n(OH–) = xn2 = zn1, откуда  ,
,
где n(OH–) – количество вещества ионов OH–, необходимое для осаждения, моль; n2 – количество вещества щелочи  , необходимое для осаждения, моль; z – величина заряда катиона Mz+; x – кислотность щелочи.
, необходимое для осаждения, моль; z – величина заряда катиона Mz+; x – кислотность щелочи.
 ,
,
где m2 – искомый расход щелочи, необходимый для полного осаждения, кг в год; М2 – молярная масса щелочи, г/моль; ω – массовая доля избытка, %; 100% – пересчетный коэффициент; 1000 г/кг – пересчетный коэффициент.
pH
4. Если суточный объем очищаемой воды равен V м3, значение водородного показателя исходного раствора равно pH, то с учетом ω%-го содержания действующего вещества в пересчете на карбонат кальция в известняковой муке ее расход составит __ кг в сутки.
Решение.
n1 = 1000V·10–pH =V·103–pH,
где n1 – количество вещества ионов H+ в суточном объеме очищаемой воды, моль; 1000 л/м3 – пересчетный коэффициент; V – суточный объем очищаемой воды, м3;pH – водородный показатель исходного раствора.
Краткое ионное уравнение реакции:
2 H+ + CaCO3 = Ca2+ + CO2↑ + H2O.
Из него видно, что
 ,
,
где n2 – необходимое для нейтрализации количество вещества карбоната кальция, моль.
 ,
,
где m2 – искомый расход известняковой муки, кг в сутки; М2 – молярная масса карбоната кальция, г/моль; 10 г/(кг·%) – пересчетный коэффициент; ω – массовая доля карбоната кальция в известняковой муке, %.
5. Сколько мл cэкн. раствора слабой одноосновной кислоты нужно добавить к V2мл c М раствора натриевой соли этой кислоты, чтобы получить раствор с водородным показателем pH?
Решение.
рКa(CH3COOH) = 4,74.

где nc – количество вещества соли, ммоль; c – молярная концентрация раствора соли, моль/л; V2 – объем раствора соли, мл.
 Согласно уравнению Гендерсона-Гассельбаха для кислотной буферной системы
Согласно уравнению Гендерсона-Гассельбаха для кислотной буферной системы
 откуда
откуда 
где pH – водородный показатель буферного раствора; рКa – показатель константы диссоциации кислоты; nк – количество вещества кислоты, ммоль.
 ,
,
где V1 – искомый объем раствора кислоты, мл; сэк – молярная концентрация эквивалентов раствора кислоты, моль/л.
6. Найти величину буферной емкости буферного раствора, если после добавления V2мл cэкн. раствора щелочи к V1мл этого раствора pH последнего увеличивается с pH1до pH2.
Решение.
 ,
,
где  – искомая буферная емкость по щелочи, моль/л; сэк – молярная концентрация эквивалентов раствора щелочи, моль/л; V2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V1 – исходный объем буферного раствора, мл.
– искомая буферная емкость по щелочи, моль/л; сэк – молярная концентрация эквивалентов раствора щелочи, моль/л; V2 – объем раствора щелочи, мл; pH2 и pH1 – значения водородного показателя буферного раствора после и до добавления щелочи; V1 – исходный объем буферного раствора, мл.
7. Определить буферную емкость системы, если для изменения ее pH от pH1до pH2 добавили к V1 мл системы V2мл cэкн. сильной кислоты.
Решение.
 ,
,
где  – искомая буферная емкость по кислоте, моль/л; сэк – молярная концентрация эквивалентов раствора кислоты, моль/л; V2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V1 – исходный объем буферной системы, мл.
– искомая буферная емкость по кислоте, моль/л; сэк – молярная концентрация эквивалентов раствора кислоты, моль/л; V2 – объем раствора кислоты, мл; pH2 и pH1 – значения водородного показателя буферной системы после и до добавления кислоты; V1 – исходный объем буферной системы, мл.
8. Активная кислотность биологической жидкости равна [H+] моль/л. Найти pH жидкости.
Решение.
pH = –lg[H+],
где pH – искомое значение водородного показателя; [H+] – активная кислотность, моль/л.
9. Определить концентрации гидроксид-ионов в крови человека при t
|
из
5.00
|
Обсуждение в статье: ОКИСЛИТЕЛЬНО-ВОССТАНОВИТЕЛЬНОЕ ТИТРОВАНИЕ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

