 |
Главная |
Опыт 2. Стандартизация раствора ЭДТА
|
из
5.00
|
Комплексонометрическое титрование
Комплексонометрическим титрованием (комплексонометрией) называют титриметрический метод количественного анализа, основанный на аналитическом использовании реакций комплексообразования ионов металла с полидентантными хелатообразующими органическими реагентами – комплексонами. В аналитической химии наиболее часто применяют комплексон (III), двунатриевую соль этилендиаминтетрауксусной кислоты (ЭДТА), Na2H2Y,
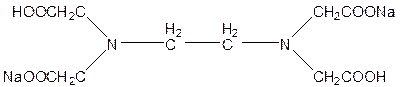
Далее для краткости обозначим анион ЭДТА как Y4–, тогда уравнение реакции комплексообразования, с двухзарядными ионами металлов будет иметь вид
 .
.
При расчетах результатов титрования необходимо учитывать, что вне зависимости от заряда иона металла комплексообразователя всегда образуются комплексы состава 1:1. 1 Моль эквивалента ЭДТА M[1/1(Na2H2Y)], всегда взаимодействует с 1 моль эквивалента металла М[1/1(МetZ+)]. Отсюда следует, что 1 моль эквивалента гексадентатного ЭДТА в реакциях комплексообразования равен его молярной массе, а 1 моль эквивалента металла должен быть численно равен атомной массе металла, вступающего в реакцию с 1 моль ЭДТА.
Опыт 1. Приготовление ЭДТА
В качестве титранта в методе комплексонометрического титрования применяют стандартный раствор ЭДТА. Раствор готовят из двунатриевой соли ЭДТУ (ЭДТА, трилон Б, комплексон III), кристаллизующейся с двумя молекулами воды. Ее состав отвечает формуле Na2C10H14N2×2H2O. Молекулярная масса этого соединения составляет 372,242 у. е. Применение натриевой соли этилендиаминтетрауксусной кислоты для приготовления стандартного раствора обусловлено ее лучшей растворимостью в воде по сравнению с кислотой. Так, при 22 оС растворимость ЭДТА составляет 10,8 г на 100 г воды, а ЭДТУ только 0,2 г на 100 г воды.
Для выполнения лабораторных работ готовят 500 мл 0,025 М раствора ЭДТА. Навеска, необходимая для приготовления указанного объема стандартного раствора ЭДТА, составляет:
 г
г
Выполнение работы.
1. Навеску ЭДТА 4 – 5 г взвешивают в бюксе на технических весах, переносят в бутылку вместимостью 500 мл и доводят до метки дистиллированной водой.
2. Бюкс после перенесения навески взвешивают на технических весах и по разности двух взвешиваний находят массу навески ЭДТА. Раствор в колбе тщательно перемешивают, растворение ЭДТА происходит медленно.
Опыт 2. Стандартизация раствора ЭДТА
Лучшим первичным стандартом для установления титра и молярной концентрации эквивалента C[1/1(Na2H2Y)] ЭДТА является раствор хлорида цинка, приготовленный растворением металлического цинка квалификации «хч». Реакцию титрования проводят при рН = 10 в присутствии индикатора эриохромовый черный Т:
Zn2+ + H2Y2– = [ZnY]2– + 2H+
Для приготовления 100 мл 0,025 М раствора хлорида цинка необходимо взять на аналитических весах навеску металлического цинка.
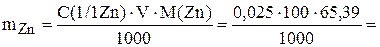 0,163 г
0,163 г
Реактивы и оборудование. Металлический цинк квалификации «хч»; титрант – раствор ЭДТА; мерная колба 100,00 см3; коническая колба для титрования объемом 250 см3; пипетка на 10,00 см3; бюретка объемом 25 см3; эриохромовый черный Т; аммиачный буфер рН = 10.
Выполнение работы
1. Рассчитанную навеску Zn взвешивают сначала на технических, а затем на аналитических весах, переносят в мерную колбу вместимостью 100 мл, добавляют 5 мл концентрированной HCl и после полного растворения навески раствор в колбе доводят до метки дистиллированной водой и тщательно перемешивают. Приготовленный таким образом раствор используют для стандартизации раствора ЭДТА.
Расчет эквивалентной концентрации раствора Zn:

2. Готовят бюретку для титрования и заполняют ее стандартным раствором ЭДТА.
3. В коническую колбу для титрования отбирают пипеткой аликвотную часть раствора цинка (10,00 мл), добавляют по каплям раствор аммиака (1:5) до появления белого осадка гидроксида цинка, а потом, до полного его растворения, 2 мл аммиачного буферного раствора и разбавляют дистиллированной водой до 100 мл.
4. Добавляют на кончике шпателя индикатор эриохромовый черный Т и после полного растворения индикатора титруют раствором ЭДТА до изменения окраски раствора от красно-фиолетовой до чистой синей.
Титрование повторяют несколько раз до получения не менее четырех сходящихся результатов титрования.
5. Результаты заносят в таблицу:
Таблица. Стандартизация раствора ЭДТА
Определяемое вещество – Zn
С(1/1Zn) =
Vколбы = 100,00 мл
Титрант – раствор ЭДТА неизвестной концентрации
Индикатор – эриохромовый черный Т
| № | Va(Zn) | VЭ(ЭДТА) |
 , где n – число параллельных опытов.
, где n – число параллельных опытов.
5. Расчет эквивалентной концентрации ЭДТА проводят по формуле

|
из
5.00
|
Обсуждение в статье: Опыт 2. Стандартизация раствора ЭДТА |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

