 |
Главная |
Катионы III аналитической группы
|
из
5.00
|
Общая характеристика
В III аналитическую группу входит большое количество катионов, образованных различными элементами:
ü s2- (Ве2+) и p1-элементами;
ü 3d-, 4d- и 5d-элементами;
ü f-элементами.
Однако все они имеют общее свойство, отличающее их от катионов I и II групп. Это способность осаждаться в виде сульфидов или гидроксидов при действии группового реагента – (NH4)2S в присутствии аммиачного буфера. Сульфиды катионов III группы, не растворимые в воде, растворяются в разбавленных минеральных кислотах, поэтому они не осаждаются сероводородом из кислых растворов.
Катионы III группы, в отличие от катионов II группы, образуют нерастворимые гидроксиды и растворимые в воде сульфаты. Одним из характерных свойств катионов III группы является их способность образовывать комплексные соединения. Многие из них вступают в реакции окисления-восстановления.
Большинство соединений катионов III группы окрашено. Так, соли Cr3+ имеют сине-зелёную окраску, соли Fe3+ – жёлтую. Хром и марганец в высших степенях окисления образуют окрашенные анионы: CrO42– – жёлтого цвета, Cr2O72– – оранжевого, MnO4– – малиново-фиолетового. Окрашены также некоторые гидроксиды и все сульфиды, за исключением ZnS.
В химической технологии наиболее часто используются следующие катионы III группы: Fe2+, Fe3+, Zn2+, Al3+, Cr3+, Mn2+.
Характерные реакции ионов Al3+
1) Реакция с ализарином.
Ализарин (1,2-диоксиантрахинон) при реакции с катионами Al3+ в аммиачной среде образует малорастворимые комплексные соединения ярко-красного цвета, называемые «алюминиевыми лаками». Реакция протекает по схеме

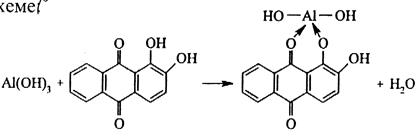
Комплексы устойчивы в уксуснокислой среде. Ализарин – специфический реактив, позволяющий определять Al3+ в присутствии других катионов. Реакция высокочувствительна – предел обнаружения 0,5 мкг. Мешают катионы Zn2+, Mn2+, Cr3+, Fe3+. Для их маскировки используют K4[Fe(CN)6], с которым мешающие ионы образуют нерастворимые в воде гексацианоферраты (II). Реакция выполняется в двух вариантах – как пробирочная и как капельная.
2) Реакция с аммиаком.
При действии водного раствора аммиака ионы алюминия выпадают в виде белого студенистого осадка гидроксида:
Al3+ + 3OH– → Al(OH)3↓.
Наиболее полное осаждение гидроксида происходит при рН≈5–6.
3) Реакция со щелочами.
Гидроксид натрия (калия) образуют с ионами Al3+ белый осадок гидроксида алюминия Al(OH)3. Наиболее полное осаждение наблюдается в интервале рН 4–7,8. При дальнейшем прибавлении щёлочи амфотерный гидроксид алюминия растворяется с образованием гидроксоалюминатов. Если снова понизить рН среды до значения ≈5, то гидроксоалюминаты разрушаются и снова выпадает осадок Al(OH)3.
Характерные реакции ионов Cr3+
1) Реакция с пероксидом водорода.
Пероксид водорода в щелочной среде окисляет ионы Cr3+ до
CrO42–:
2Cr(OH)3 + 3H2O2 + 4OH– → 2CrO42– +8H2O.
Образуется жёлтый раствор хромата. При действии H2O2 на растворы хроматов образуются различные пероксокомплексы хрома, окраска которых зависит от рН среды. В кислой среде образуются комплексные соединения голубого, а в нейтральной – фиолетового цвета. В водных растворах пероксидные комплексы хрома неустойчивы, но устойчивы в органических растворителях.
2) Реакция с дифенилкарбазидом.
Дифенилкарбазид (I) взаимодействует с ионами Cr (VI) в сильнокислой среде, при этом появляется фиолетовое окрашивание. Предполагается следующий механизм реакции. Сначала ионы Cr (VI) окисляют дифенилкарбазид до бесцветного дифенилкарбазона (II), восстанавливаясь при этом до Cr3+:


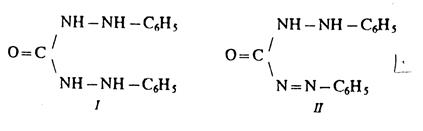
Ионы Cr3+ образуют с дифенилкарбазоном (II) красно-фиолето-вые внутрикомплексные соединения.
Характерные реакции ионов Fe3+
1) Реакция с гексацианоферратом (II) калия.
Это наиболее характерная и чувствительная реакция на ионы Fe3+, в результате которой образуется тёмно-синий осадок:
4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓.
Реакцию обязательно проводят в кислой среде, т. к. образующиеся комплексы легко разрушаются в щелочной среде с выделением гидроксида железа. Последующее подкисление смеси возвращает окраску.
2) Реакция с роданидом аммония (тиоцианатом).
Ионы Fe3+ образуют окрашенное в кроваво-красный цвет соединение, состав которого определяется концентрацией роданид-ионов:
Fe3+ + nCNS– → Fe(CNS)n.
С увеличением концентрации роданид-ионов окраска усиливается, поэтому реакцию необходимо проводить с избытком роданида. Для предотвращения выпадения бурого осадка гидроксида железа следует вести обнаружение в кислой среде.
Характерные реакции ионов Fe2+
1) Реакция с гексацианоферратом (III) калия.
Это наиболее характерная и чувствительная реакция на ионы Fe2+, в результате которой образуется интенсивно-синий осадок:
3Fe2+ +2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓.
Осадок не растворяется в кислотах, но разлагается в щелочной среде с образованием гидроксидов железа. Реакция очень чувствительна: предел обнаружения составляет 0,05 мкг.
2) Реакция с диметилглиоксимом
Диметилглиоксим (H2D) образует с ионами Fe2+ в аммиачных растворах устойчивые комплексные соединения красного цвета:
Fe2+ + 2H2D + 3NH3 + H2O → Fe[(HD)2(H2O)(NH3)] + 2NH4+.
Комплексные соединения Fe2+ с H2D хорошо растворимы в воде. Мешают катионы Ni2+, образующие нерастворимые в воде диметилглиоксиматы никеля. Мешающее влияние ионов Fe3+, образующих в аммиачной среде окрашенный гидроксид, устраняют добавлением лимонной, щавелевой или винной кислоты.
Характерные реакции ионов Mn2+
1) Реакция со щавелевой кислотой.
Щавелевая кислота образует с MnO(OH)2 комплексное соединение состава H[Mn(C2O4)2], окрашенное в малиново-розовый цвет:
2MnO(OH)2 + 5H2C2O4 → 2H[Mn(C2O4)2] + 2СО2↑ + 6H2O.
Мешают катионы Fe2+ и Fe3+. Для их маскировки используют NaF.
2) Реакции окисления катионов Mn2+ до перманганат-ионов.
Катионы Mn2+ под действием различных окислителей окисляются до перманганат-ионов, окрашенных в малиново-фиолетовый цвет. В качестве окислителей используют висмутат натрия NaBiO3, диоксид свинца PbO2, персульфат аммония (NH4)2S2O8 и др. Окисление висмутатом натрия протекает по схеме:
2Mn2+ + 5NaBiO3 + 14H+ → 2MnO4– + 5Bi3+ + 5Na+ + 7H2O.
3) Реакция с ПАН (1-(2-пиридилазо)-2-нафтол).
ПАН (структура I) образует с ионами Mn2+ при рН=7‑10 малорастворимые в воде комплексные соединения красно-фиолетового цвета с предполагаемой структурой II:
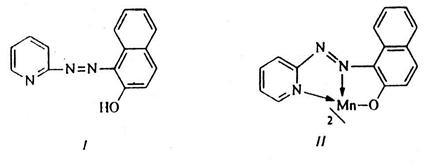
Характерные реакции ионов Zn2+
1) Реакция с дитизоном.
Дитизон (дифенилтиокарбазон) образует с ионами Zn2+ внутрикомплексные соединения, хорошо растворимые в органических растворителях (CCl4, CHCl3):
H2Dz + Zn2+ + → Zn(HDz)2 + 2H+.
Эти соединения в щелочной среде окрашены в красный цвет, причём слой органического растворителя имеет более интенсивную окраску, чем водный.
Мешающие ионы, способные к образованию дитизонатных комплексов (Cd2+, Pb2+, Cu2+), маскируют тиосульфатом, цианидом или осаждают в виде сульфидов.
2) Реакция с аммиаком.
При постепенном добавлении гидроксида аммония к раствору, содержащему ионы Zn2+, выпадает белый осадок гидроксида цинка, который растворяется в избытке аммиака с образованием комплексов:
Zn(OH)2 + 6NH3 → [Zn(NH3)6](OH)2.
|
из
5.00
|
Обсуждение в статье: Катионы III аналитической группы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

