 |
Главная |
Важнейшие соединения хлора
|
из
5.00
|
Характеристика элементов VII группы главной подгруппы, на примере хлора
Общая характеристика подгруппы
Таблица 1. Номенклатура элементов подгруппы VIIА
| F | Cl | Br | I | |
| Русские названия | Фтор | Хлор | Бром | Иод |
| Латинские названия | Ftorum (Фторум) | Chlorum (Хлорум) | Bromum (Бромум) | Iodum (Иодум) |
| Русские написания корней латинских названий | Фтор | Хлор | Бром | Иод |
P-элементы, типические, неметаллы (астат - полуметалл), галогены.
 Электронная диаграмма элемента Hal (Hal ≠ F):
Электронная диаграмма элемента Hal (Hal ≠ F):
Для элементов подгруппы VIIA характерны следующие валентности:
Таблица 2. Валентность
| Элемент | Валентности |
| F | |
| Cl | 1; 3; 5; 7 |
| Br | 1; 3; 5; 7 |
| I | 1; 3; 5; 7 |
| At | 1; 3; 5 |
3. Для элементов подгруппы VIIA характерны следующие степени окисления:
Таблица 3. Степени окисления элементов
| Атом | Устойчивые степени окисления |
| 9F | -1; 0 |
| 17Cl | -1; 0; +1; +3; (+4); +5; (+6); +7 |
| 35Br | -1; 0; +1; +3; (+4); +5; +7 |
| 53I | -1; 0; +1; +3; +5; +7 |
Характеристика химического элемента
Хлор – элемент VII А группы. Порядковый номер 17
Относительная атомная масса: 35,4527 а. е. м. (г/моль)
 Количество протонов, нейтронов, электронов: 17,18,17
Количество протонов, нейтронов, электронов: 17,18,17
Строение атома:

Электронная формула:
Типичные степени окисления: -1, 0, +1, +3, +4, +5, +7
Энергия ионизации: 1254,9(13,01) кДж/моль (эВ)
Сродство к электрону: 349 (кДж/моль)
Электроотрицательность по Полингу: 3,20
Характеристика простого вещества
Тип связи: ковалентная неполярная
Молекула двухатомная
Изотопы: 35Cl (75,78 %) и 37Cl(24,22 %)
Тип кристаллической решетки: молекулярная
Термодинамические параметры
Таблица 4
| Параметр | Значение |
| ΔH°обр. (298 К, газ) | 0 (кДж/моль) |
| ΔS°обр (298 К, газ) | 222,9 (Дж/моль·K) |
| ΔHплавления | 6,406 (кДж/моль) |
| ΔHкипения | 20,41 (кДж/моль) |
| Энергия гомолитического разрыва связи Х-Х | 243 (кДж/моль) |
| Энергия гетеролитического разрыва связи Х-Х | 1150 (кДж/моль) |
Физические свойства
Таблица 5
| Свойство | Значение |
| Цвет (газ) | Жёлто-зелёный |
| Температура кипения | −34 °C |
| Температура плавления | −100 °C |
| Температура разложения (диссоциации на атомы) | ~1400 °C |
| Плотность (газ, н.у.) | 3,214 г/л |
| Теплоемкость (298 К, газ) | 34,94 (Дж/моль·K) |
| Критическая температура | 144 °C |
| Критическое давление | 76 атм |
| Запах | Резкий, удушающий |
Химические свойства
Водный раствор хлора в большой степени подвергается дисмутации («хлорная вода»)
1 стадия: Cl2 + H2O = HCl + HOCl
2 стадия: HOCl = HCl + [О] – атомарный кислород
Окислительная способность в подгруппе уменьшается от фтора к йоду = ˃
Хлор сильный окислитель:
1. Взаимодействие с простыми веществами
a) с водородом:
Cl2 + H2 = 2HCl
б) с металлами:
Cl2 + 2Na = 2NaCl
3Cl2 + 2Fe = 2FeCl3
в) с некоторыми менее электроотрицательными неметаллами:
3Cl2 + 2P = 2PCl3
Cl2 + S = SCl2
С кислородом, углеродом и азотом хлор непосредственно не реагирует!
2. Взаимодействие со сложными веществами
а) с водой: см. выше
б) с кислотами: не реагирует!
в) с растворами щелочей:
на холоду: Cl2 +2 NaOH = NaCl + NaClO + H2O
при нагревании: 3Cl2+ 6 KOH = 5KCl + KClO3 + 3H2O
д) со многими органическими веществами:
Cl2 + CH4 = CH3Cl + HCl
C6H6 + Cl2 = C6H5Cl + HCl
Важнейшие соединения хлора
 Хло́роводоро́д, хло́ристый водоро́д (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −114,22 °C HCl переходит в твёрдое состояние. В твёрдом состоянии хлороводород существует в виде двух кристаллических модификаций: ромбической, устойчивой ниже и кубической.
Хло́роводоро́д, хло́ристый водоро́д (HCl) — бесцветный, термически устойчивый газ (при нормальных условиях) с резким запахом, дымящий во влажном воздухе, легко растворяется в воде (до 500 объёмов газа на один объём воды) с образованием хлороводородной (соляной) кислоты. При −114,22 °C HCl переходит в твёрдое состояние. В твёрдом состоянии хлороводород существует в виде двух кристаллических модификаций: ромбической, устойчивой ниже и кубической.
Водный раствор хлористого водорода называется соляной кислотой. При растворении в воде протекают следующие процессы:
HClг + H2Oж = H3O+ж + Cl−ж
Процесс растворения сильно экзотермичен. С водой HCl образует азеотропную смесь. Является сильной одноосновной кислотой. Энергично взаимодействует со всеми металлами, стоящими в ряду напряжений левее водорода, с основными и амфотерными оксидами,основаниями и солями, образуя соли — хлориды:
Mg + 2 HCl → MgCl2 + H2↑
FeO + 2 HCl → FeCl2 + H2O
При действии сильных окислителей или при электролизе хлороводород проявляет восстановительные свойства:
MnO2 + 4 HCl → MnCl2 + Cl2↑ + 2 H2O
При нагревании хлороводород окисляется кислородом (катализатор — хлорид меди(II) CuCl2):
4 HCl + O2 → 2 H2O +2 Cl2↑
Однако, концентрированная соляная кислота реагирует с медью, при этом образуется комплекс одновалентной меди:
2 Cu + 4 HCl → 2 H[CuCl2] + H2↑
Смесь 3 объемных частей концентрированной соляной и 1 объемной доли концентрированной азотной кислот называется «царской водкой». Царская водка способна растворять даже золото и платину. Высокая окислительная активность царской водки обусловлена присутствием в ней хлористого нитрозила и хлора, находящихся в равновесии с исходными веществами:
4 H3O+ + 3 Cl− + NO3− = NOCl + Cl2 + 6 H2O
Благодаря высокой концентрации хлорид-ионов в растворе металл связывается в хлоридный комплекс, что способствует его растворению:
3 Pt + 4 HNO3 + 18 HCl → 3 H2[PtCl6] + 4 NO↑ + 8 H2O
Для хлороводорода также характерны реакции присоединения к кратным связям (электрофильное присоединение):
R-CH=CH2 + HCl → R-CHCl-CH3
R-C≡CH + 2 HCl → R-CCl2-CH3
Оксиды хлора — неорганические химические соединения хлора и кислорода, общей формулой: ClхOу.
Хлор образует следующие оксиды: Cl2O, Cl2O3, ClO2, Cl2O4, Cl2O6, Cl2O7. Кроме того известны: короткоживущий радикал ClO, радикал пероксид хлора ClOO и радикал тетраоксид хлора ClO4.
Ниже в таблице представлены свойства устойчивых оксидов хлора:
Таблица 6
| Свойство | Cl2O | ClO2 | ClOClO3 | Cl2O6(ж)↔2ClO3(г) | Cl2O7 |
| Цвет и состояние при комн. температуре | Жёлто-коричневый газ | Жёлто-зелёный газ | Светло-жёлтая жидкость | Тёмно-красная жидкость | Бесцветная жидкость |
| Степень окисления хлора | (+1) | (+4) | (+1), (+7) | (+6) | (+7) |
| Т. пл., °C | −120,6 | −59 | −117 | 3,5 | −91,5 |
| Т. кип., °C | 2,0 | 44,5 | |||
| d (ж, 0°C), г*см-3 | — | 1,64 | 1,806 | — | 2,02 |
| ΔH°обр(газ, 298 К), кДж*моль-1 | 80,3 | 102,6 | ~180 | (155) | |
| ΔG°обр(газ, 298 К), кДж*моль-1 | 97,9 | 120,6 | — | — | — |
| S°обр(газ, 298 К), Дж*K-1*моль-1 | 265,9 | 256,7 | 327,2 | — | — |
| Дипольный момент μ, Д | 0,78 ± 0,08 | 1,78 ± 0,01 | — | — | 0,72 ± 0,02 |
 Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты — соединение хлора в степени окисления +1 с кислородом.
Оксид хлора (I), оксид дихлора, ангидрид хлорноватистой кислоты — соединение хлора в степени окисления +1 с кислородом.
В нормальных условиях представляет собой буровато-жёлтый газ с характерным запахом, напоминающим запах хлора. При температурах ниже 2 °C — жидкость золотисто-красного цвета. Ядовит: поражает дыхательные пути. Самопроизвольно медленно разлагается:

При больших концентрациях взрывоопасен. Плотность при нормальных условиях 3,22 кг/м³. Растворяется в четырёххлористом углероде. Хорошо растворим в воде с образованием слабой хлорноватистой кислоты:

Быстро реагирует со щелочами:
Cl2O + 2NaOH(разб.) = 2NaClO + H2O
Диоксид хлора - кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:

Образующаяся хлористая кислота очень неустойчива и разлагается:

 Диоксид хлора — оксид хлора (IV), соединение хлора и кислорода, формула: ClO2.
Диоксид хлора — оксид хлора (IV), соединение хлора и кислорода, формула: ClO2.
В нормальных условиях ClO2 — газ красновато-жёлтого цвета, с характерным запахом. При температурах ниже 10 °C ClO2 представляет собой жидкость красно-коричневого цвета. Малоустойчив, взрывается на свету, при контактах с окислителями и при нагревании. Хорошо растворим в воде. Из-за взрывоопасности диоксид хлора невозможно хранить в виде жидкости.
Кислотный оксид. При растворении в воде образуются хлористая и хлорноватая кислоты (реакция диспропорционирования). Разбавленные растворы устойчивы в темноте, на свету медленно разлагаются:

Образующаяся хлористая кислота очень неустойчива и разлагается:

Проявляет окислительно-восстановительные свойства.
2ClO2 + 5H2SO4 (разб.) + 10FeSO4 = 5Fe2(SO4)3 + 2HCl + 4H2O
ClO2 + 2NaOHхол. = NaClO2 + NaClO3 + H2O
ClO2 + O3 = ClO3 + O2
ClO2 реагирует со многими с органическими соединениями и выступает окислителем средней силы.
 Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
Хлорноватистая кислота — HClO, очень слабая одноосновная кислота, в которой хлор имеет степень окисления +1. Существует лишь в растворах.
В водных растворах хлорноватистая кислота частично распадается на протон и гипохлорит-анион ClO−:

Неустойчива. Хлорноватистая кислота и её соли — гипохлориты — сильные окислители. Реагирует с соляной кислотой HCl, образуя молекулярный хлор:
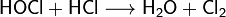
HClO + NaOH (разб.) = NaClO + H2O 
Хлористая кислота — HClO2, одноосновная кислота средней силы.
Хлористая кислота НClO2 в свободном виде неустойчива, даже в разбавленном водном растворе она быстро разлагается:

Нейтрализуется щелочами.
HClO2 + NaOH(разб. хол.) = NaClO2 + H2O
Ангидрид этой кислоты неизвестен.
Раствор кислоты получают из её солей - хлоритов, образующихся в результате взаимодействия ClO2 со щёлочью:
Проявляет окислительно – восстановительные свойства.
5HClO2 + 3H2SO4 (разб.) + 2KMnO4 = 5HClO3 + 2MnSO4 + K2SO4 + 3H2O
 Хлорноватая кислота — HClO3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается:
Хлорноватая кислота — HClO3, сильная одноосновная кислота, в которой хлор имеет степень окисления +5. В свободном виде не получена; в водных растворах при концентрации ниже 30% на холоде довольно устойчива; в более концентрированных растворах распадается:

Хлорноватая кислота — сильный окислитель; окислительная способность увеличивается с возрастанием концентрации и температуры. HClO3 легко восстанавливается до соляной кислоты:
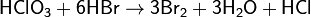
HClO3 + 5HCl(конц.) = 3Cl2 + 3H2O
HClO3 + NaOH(разб.) = NaClO3 + H2O
При пропускании смеси SO2 и воздуха сквозь сильнокислый раствор, образуется диоксид хлора:

В 40%-ной хлорноватой кислоте воспламеняется, например, фильтровальная бумага.
8. Нахождение в природе:
В земной коре хлор - самый распространённый галоген. Поскольку хлор очень активен, в природе он встречается только в виде соединений в составе минералов.
Таблица 7. Нахождение в природе
| В природе: | |||||
| F | Cl | Br | I | At | |
| Сколько: кора, w % | 8∙10-2 | 4,5∙10−2 | 3∙10−5 | »1∙10−4 | |
| Степень конц-ии: | Рудообразующие | Рассеянные | |||
| Состояние: | Связанные |
Таблица 7. Минеральные формы
| Минеральные формы | ||||
| F | Cl | Br | I | At |
| CaF2 Плавиковый шпат 3Ca3(PO4)∙CaF2 Фторапатит | NaCl Галит KCl Сильвин KCl∙MgCl2∙6H2O карналлит | Скважины Водоросли Вулканы |
Самые большие запасы хлора содержатся в составе солей вод морей и океанов.
Получение
Химические методы получения хлора малоэффективны и затратны. На сегодняшний день имеют в основном историческое значение. Может быть получен при взаимодействии перманганата калия с соляной кислотой:

Метод Шееле
Первоначально промышленный способ получения хлора основывался на методе Шееле, то есть реакции пиролюзита с соляной кислотой:

Метод Дикона
Метод получения хлора каталитическим окислением хлороводорода кислородом воздуха. 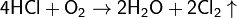
Электрохимические методы
Сегодня хлор в промышленных масштабах получают вместе с гидроксидом натрия и водородом путём электролиза раствора поваренной соли, основные процессы которого можно представить суммарной формулой:

Применение
· Оконный профиль, изготовленный из хлорсодержащих полимеров
· Основным компонентом отбеливателей является Лабарракова вода (гипохлорит натрия)
· В производстве поливинилхлорида, пластикатов, синтетического каучука.
· Производство хлорорганических. На получение средств защиты растений расходуется значительная часть производимого хлора. Один из самых важных инсектицидов - гексахлорциклогексан (часто называемый гексахлораном).
· Использовался как боевое отравляющее вещество, а также для производства других боевых отравляющих веществ: иприт, фосген.
· Для обеззараживания воды - «хлорирования».
· В пищевой промышленности зарегистрирован в качестве пищевой добавки E925.
· В химическом производстве соляной кислоты, хлорной извести, бертолетовой соли, хлоридов металлов, ядов, лекарств, удобрений.
· В металлургии для производства чистых металлов: титана, олова, тантала, ниобия.
· Как индикатор солнечных нейтринов в хлор-аргонных детекторах.
Многие развитые страны стремятся ограничить использование хлора в быту, в том числе потому, что при сжигании хлорсодержащего мусора образуется значительное количество диоксинов.
|
из
5.00
|
Обсуждение в статье: Важнейшие соединения хлора |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

