 |
Главная |
Химические свойства спиртов
|
из
5.00
|
Спирты являются очень слабыми кислотами .Их pKa = 16-18. Однако они гораздо более сильные кислоты, чем ацетилен (рКа= 22) и аммиак (рКа=35). Поэтому легко, при комнатной температуре низшие спирты реагируют с ацетиленидами щелочных металлов и с амидом натрия:
Со щелочами спирты реагируют обратимо. Равновесие сильно смещено в сторону исходных веществ, так как вода значительно более сильная кислота, чем спирты:
В связи с этим при реакциях галогенпроизводных бензола со щелочами, проводимых в спирте, получается больше продукта I, чем II, так как
скорость реакции с метилат –ионом намного выше, чем с гидроксид-ионом, хотя последнего в равновесии больше.
Спирты могут взаимодействовать с очень многими реагентами. Ниже приведены наиболее важные из этих реакций:
Спиртыреагируют с активными металлами:


Реакции, приведённые ниже, используются для абсолютирования спиртов, то есть для удаления из них воды путём её химического связывания. К магниевым стружкам приливают
спирт, содержащий около 4% воды, и кипятят, добавляя йод для активации первой реакции:
Полученный этилат магния самопроизвольно реагирует с водой – обычный гидролиз соли слабого основания и слабой кислоты:

С менее активными металлами, такими как Al, Zn, Fe спирты не реагируют.
Спирты могут реагировать с концентрированными галогеноводородными кислотами в присутствии ZnCl2 (р. Лукаса):



Эти реакции – хороший пример для иллюстрации положения теории А.М.Бутлерова о влиянии строения на химические свойства. Как видно скорость реакции с одним и тем же реагентом в случае третичных спиртов намного выше, чем для вторичных, а те в свою очередь реагируют быстрее первичных.
С кислородсодержащими кислотами спирты реагируют с образованием сложных эфиров этих кислот:



Спирты реагируют с аммиаком. Реакция обратима. Равновесие в ней смещают вправо избытком аммиака в соответствии с принципом Ле-Шателье:

 Спирты реагируют с аминами.
Спирты реагируют с аминами.

Примежмолекулярной дегидратации спиртов образуются простые эфиры:

 При дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия равновесие смещают вправо, понижая давление, так как в реакции из одного моля газа получается два (в соответствии с принципом Ле-Шателье)
При дегидратировании в газовой фазе на гетерогенном катализаторе – оксиде алюминия равновесие смещают вправо, понижая давление, так как в реакции из одного моля газа получается два (в соответствии с принципом Ле-Шателье)
При внутримолекулярной дегидратации получаются алкены. В соответствии с правилом Зайцева водород преимущественно отщепляется от менее гидрогенизированного атома углерода из двух соседних с тем атомом углерода, который связан с гидроксилом
Спирты взаимодействуют с непредельными углеводородами:
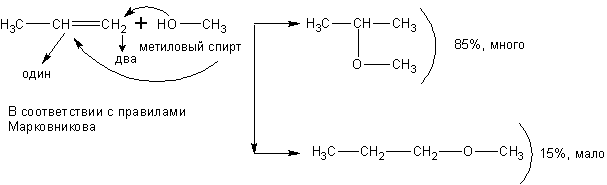

При реакции спиртов с ацетиленом получаются очень важные для синтеза полимеров виниловые эфиры:
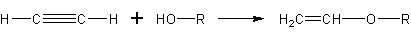
Алкадиены со спиртами так же дают непредельные простые эфиры:

С аренами спирты не реагируют. Они не реагируют также с галогенпроизводными алканов. Однако соли спиртов – алкоголяты реагируют с ними очень легко. В результате реакции получаются простые эфиры (лучший способ получения несимметричных простых эфиров):
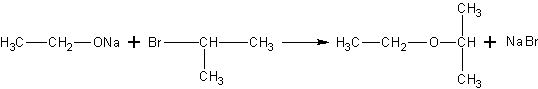
 Реакция спиртов с альдегидами (получение полуацеталей).
Реакция спиртов с альдегидами (получение полуацеталей).
 При реакции спиртов с полуацеталями получаются ацетали:
При реакции спиртов с полуацеталями получаются ацетали:
Полуацетали и ацетали, как правило, обладают хорошим запахом, выделяются из растений и часто служат компонентами парфюмерных композиций.
Реакция спиртов с кетонами аналогична их взаимодействию с полуацеталями, но проходит в более жестких условиях.
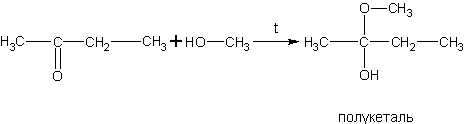

Спиртывзаимодействуют с альдегидами и кетонами по реакции Меервейна – Понндорфа – Верлея, о которой было подробно рассказано в пункте 9 способов получения спиртов. Здесь приведём другой пример этой реакции:
 Спирты взаимодействуют также и с карбоновыми кислотами. При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией этерификации.
Спирты взаимодействуют также и с карбоновыми кислотами. При этом обратимо получаются сложные эфиры и вода. Процесс называется реакцией этерификации.
Спирты могут взаимодействовать также со сложными эфирами. Получается новый спирт и новый сложный эфир. Реакция носит характер обратимой , катализируется кислотами и называется реакцией переэтерификации спиртом. Она очень широко применяется в синтезах душистых веществ для парфюмерных композиций.

Спирты могут окислятьсяв различных условиях до различных продуктов:
а) При горении:

б) При окислении паров первичных и вторичных спиртов оксидом медиполучаютсясоответственноальдегиды и кетоны,например:

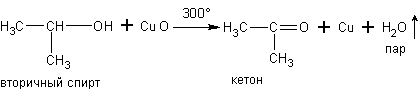
в) При дегидрировании спиртов на катализаторах платиновой группы первичные спирты окисляются до альдегидов, а вторичные - до кетонов:

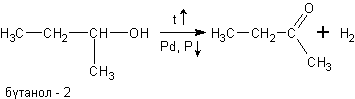
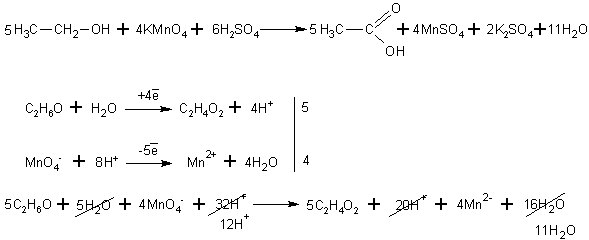
При окислении спиртов в жидкой фазе в кислой среде сильными окислителями, такими как перманганат калия, дихромат калия или висмутат натрия первичные спирты окисляются до карбоновых кислот. Вторичные - до кетонов. Например, этанол до уксусной кислоты:
Изопропиловый спирт окисляется до кетона (до пропанона )

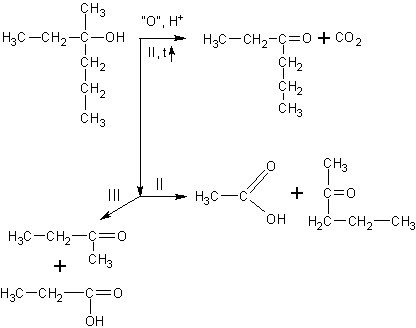 Окисление третичных спиртов идет
Окисление третичных спиртов идет
только при нагревании с разрывом C-C связи. Получается сложная смесь карбоновых кислот, кетонов и углекислый газ:
Если все алкильные радикалы одинаковы, то реакция может быть уравнена. Ниже приведена реакция окисления третичного спирта – триэтилкарбинола висмутатом натрия в среде разбавленной азотной кислоты:

|
из
5.00
|
Обсуждение в статье: Химические свойства спиртов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

