 |
Главная |
Малые циклы (циклопропан и циклобутан)
|
из
5.00
|
Циклопропан — единственный плоский цикл и большое угловое напряжение объясняет его неустойчивость. Ряд химических реакций с циклопропаном протекает с разрывом цикла, что обусловлено особенностями его электронного строения. Все атомы водорода находятся в заслоненном положении (рис. а, б). Вследствие взаимного отталкивания орбиталей атомов углерода их максимальное перекрывание осуществляется не строго по прямой,
соединяющей ядра связываемых атомов, а в некоторой степени приближается к боковому перекрыванию р-АО в этилене (рис. в). Поэтому образующиеся связи С–С нельзя отнести
к обычным s-связям. Они являются промежуточными между s- и p-связями, их называют «банановыми».
Четырехчленный цикл циклобутана также испытывает значительное угловое напряжение. Кроме того, все атомы водорода в нем находятся в заслоненном положении. Стремясь снизить напряжение он приобретает «складчатую» конформацию за счет поворота метиленовых групп вокруг С–С связи и выхода их из плоскости (рис. г). Напряженный четырехчленный цикл с атомом азота встречается в антибиотиках группы пенициллинов.
 В плоском циклопентановом цикле угловое напряжение практически отсутствует, но проявляется торсионное напряжение, которое снижается за счет перехода цикла в неплоскую конформацию «конверта». В этой конформации один из атомов углерода выходит из плоскости, в которой расположены остальные четыре атома. В такой конформации пятичленный цикл устойчив.
В плоском циклопентановом цикле угловое напряжение практически отсутствует, но проявляется торсионное напряжение, которое снижается за счет перехода цикла в неплоскую конформацию «конверта». В этой конформации один из атомов углерода выходит из плоскости, в которой расположены остальные четыре атома. В такой конформации пятичленный цикл устойчив.
КОНФОРМАЦИИ ЦИКЛОГЕКСАНА. ЦИКЛОГЕКСАНОВОЕ КОЛЬЦО
В БИОЛОГИЧЕСКИ ВАЖНЫХ СОЕДИНЕНИЯХ
В циклогексане шестичленный цикл не может быть плоским из-за наличия сильного углового и торсионного напряжений. За счет частичного поворота вокруг s-связей возникают менее напряженные неплоские конформации: кресла и ванны. Эти конформации свободны от углового напряжения, так как углы в них равны 109,5º .

Конформации циклогексана:
а — шаростержневая модель кресла; б — аксиальные (а) и экваториальные (е) связи; в — проекция Ньюмена; г — конформация ванны
Более термодинамически выгодной является конформация кресла, так как в ней отсутствуют торсионное и вандерваальсово напряжения. Шесть связей С–Н, расположенных параллельно оси симметрии данной конформации и направленных попеременно вверх и вниз, называются аксиальными (а). Остальные шесть С–Н связей расположены пол углом 109,5º к этой оси и называются экваториальными (е). Это приводит к тому, что этановые фрагменты имеют выгодную заторможенную конформацию, а бутановые — скошенную.
Для циклогексана возможны две энергетически вырожденные конформации кресла. При переходе их друг в друга аксиальные связи превращаются в экваториальные и наоборот. Такой процесс называется инверсией цикла. Инверсия осуществляется быстро и циклогексан обычно представляет собой смесь двух кресловидных конформаций с одинаковой энергией.
В замещенном циклогексане, имеющем объемные заместители у 1 и 3 углеродных атомов, направленные аксиально, возникает 1,3-диаксиальное взаимодействие. Оно обусловлено отталкиванием сближенных в пространстве аксиальных групп. Стремясь уменьшить энергию, система подвергается инверсии, и объемные заместители занимают более выгодные экваториальные положения. Циклогексановое кольцо входит в состав холестерина, стероидных гормонов и других биологически активных соединений.

В природных соединениях часто присутствуют пяти- и шестичленные циклы, содержащие гетероатомы (О, N и др). Кислород и азот находятся обычно в одинаковом с атомом углерода состоянии гибридизации, имеют небольшой размер и существенно не меняют конформационное строение аналогичного карбоцикла.
Наиболее распространенным является насыщенный шестичленный гетероцикл с атомом кислорода — тетрагидропиран. Этот цикл называется пиранозным и характерен для моносахаридов. Так, природная глюкоза существует преимущественно в конформации кресла.

|  b,D-глюкопираноза
b,D-глюкопираноза
|  a,D-глюкопиранозы
a,D-глюкопиранозы
|
Наиболее устойчивой является конформация кресла b,D-глюкопиранозы, в которой все объемные заместители (ОН, СН2ОН) находятся в экваториальном положении. Эта форма широко представлена в природе: она служит повторяющимся звеном полисахарида целлюлозы. У a,D-глюкопиранозы гидроксил у С1 находится в аксиальном положении. Данная форма глюкозы является субстратом, подвергающимся ферментативному окислению в организме человека с образованием энергии. Она содержится в крови, тканях, из нее построен резервный полисахарид гликоген.
ПОНЯТИЕ О СИММЕТРИИ МОЛЕКУЛ. ХИРАЛЬНЫЕ МОЛЕКУЛЫ
Молекула симметрична, если при перестановке в ней местами атомов или атомных групп не происходит никаких изменений ее структуры. Такая перестановка возможна с использованием элементов симметрии, таких как центр симметрии, ось симметрии, плоскость симметрии и др.
Так молекула метана является высоко симметричной, так как содержит 4 оси симметрии, проходящие через атом углерода и каждый из водородов в вершине тетраэдра, 3 оси симметрии, проходящие через атом углерода и середины двух ребер тетраэдра, 6 плоскостей симметрии, делящих тетраэдр на две симметричные половинки.

При переходе от молекулы метана к молекуле метанола число элементов симметрии уменьшается, так как исчезают оси и плоскости симметрии, не проходящие через группу ОН.
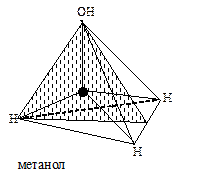

Молекула метанола имеет уже только одну ось симметрии и три плоскости симметрии, молекула этанола — одну ось симметрии и одну плоскость симметрии.
Таким образом, если из 4-х заместителей при атоме углерода хотя бы два одинаковы, то для такого тетраэдра существуют элементы симметрии и молекула является симметричной.
 Если при sp3-гибридизованном атоме углерода все четыре заместителя разные, то такая молекула уже не имеет элементов симметрии и называется хиральной. Хиральность (рукоподобие, от греческого cheir — рука) заключается в парности
Если при sp3-гибридизованном атоме углерода все четыре заместителя разные, то такая молекула уже не имеет элементов симметрии и называется хиральной. Хиральность (рукоподобие, от греческого cheir — рука) заключается в парности
существования молекул, являющихся друг по отношению к другу предметом и несовместимым с ним его зеркальным отображением. Это явление характерно и для некоторых материальных объектов, например,
левая и правая рука, право- и левозакрученная спирали (винты, болты с левой и правой нарезкой). Общим критерием, присущим всем хиральным объектам, является отсутствие элементов симметрии.
Например, в молекуле бутанола-2 атом углерода С2 связан с четырьмя разными заместителями: H, OH, CH3, C2H5. Поэтому бутанол-2 может существовать в виде двух стереоизомеров, относящихся друг к другу как предмет и его зеркальное отражение.

sp3-Гибридизованный атом углерода, у которого все четыре заместителя различные, называется асимметрическим или хиральным центром. Хиральный центр обозначается знаком *.
ОПТИЧЕСКАЯ АКТИВНОСТЬ — СВОЙСТВО, ПРИСУЩЕЕ
ХИРАЛЬНЫМ МОЛЕКУЛАМ
Соединения, содержащие хиральные центры, обладают оптической активностью — способностью по-разному вращать плоскость поляризованного света.
Поляризованный свет получают путем пропускания обычного полихроматического света через поляризатор (призму Николя или поляризационную решетку). В плоскополяризованном свете вектор электрического поля колеблется только в одной плоскости, перпендикулярной направлению распространения лучей. Эта плоскость называется плоскостью поляризации света.

Схема поляриметра:
1 — поляризатор; 2 — анализатор; 3 — окуляр с отсчетом
Один из стереоизомеров вращает плоскость поляризованного света по часовой стрелке и называется правовращающим (правое вращение обозначается +), а второй — на такой же угол против часовой стрелки (обозначается знаком -) и называется левовращающим.

правовращающая среда левовращающая среда
(+) (–)
Знак оптического вращения определяется только экспериментально с помощью
поляриметра.
ПРОЕКЦИОННЫЕ ФОРМУЛЫ Э. ФИШЕРА. ЭНАНТИОМЕРЫ
Для изображения стереоизомеров на плоскости применяются проекционные формулы Э. Фишера. При их написании руководствуются следующими правилами:
углеродный скелет располагают вертикально;
– вверху располагают наиболее старшую функциональную группу (для окси- и аминокислот — СООН);
– тетраэдр ориентируют так, чтобы хиральный центр располагался в плоскости, заместители, располагающиеся справа и слева от углеродной цепи, были направлены вперед от плоскости проекции; по вертикали располагают заместители, уходящие от наблюдателя за плоскость проекции;
– асимметрический атом углерода переносится на плоскость в точку пересечения горизонтальной и вертикальной линий.
Зеркало
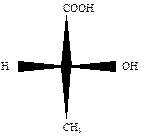
| 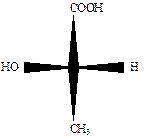
| 
|
Число стереоизомеров зависит от числа хиральных центров и определяется по формуле: N = 2n, где N — число стереоизомеров, n — число хиральных центров.
Молекулы с одним центром хиральности существуют в виде двух стереоизомеров (пары энантиомеров). Энантиомеры — это стереоизомеры, которые относятся друг к другу как предмет и его зеркальное изображение и обладают в ахиральной среде одинаковыми физическими и химическими свойствами, кроме знака оптического вращения.
ОТНОСИТЕЛЬНАЯ D-, L-НОМЕНКЛАТУРА СТЕРЕОИЗОМЕРОВ
 Поскольку до настоящего времени нет достаточно строгой теории, связывающей
Поскольку до настоящего времени нет достаточно строгой теории, связывающей
воедино конфигурацию и оптическое вращение, для названия стереоизомеров используют относительную номенклатуру, путем сравнения их конфигурации с конфигурационным стандартом. В качестве конфигурационного стандарта используют глицериновый альдегид— 2,3-дигидроксипропаналь. Глицериновый альдегид содержит хиральный центр, существует в виде двух стереоизомеров, обладающих различной оптической активностью. По предложению М. А. Розанова (1906 г.) правовращающему (+) глицериновому альдегиду была приписана D-конфигурация, т. е. группа ОН
в проекционной формуле у хирального центра располагается справа (dextra), левовращающему — L-конфигурация (laevus).


(+) D-глицериновый альдегид (-) L-глицериновый альдегид
Названия другим стереоизомерам дают путем сравнения их конфигураций с конфигурацией глицеринового альдегида (независимо от оптического вращения). Стереоизомеры, которые сходны по конфигурации с D-глицериновым альдегидом, относят к D-ряду, сходные с конфигурацией L-глицеринового альдегида — к L-ряду. Таким образом, один стереоизомер молочной кислоты получил название D-молочная кислота, другой — L-молочная кислота.


(-) D-молочная кислота (+) L-молочная кислота
РАЦЕМИЧЕСКИЕ СМЕСИ. МЕТОДЫ РАЗДЕЛЕНИЯ
При смешивании эквимолярных количеств D- и L-стереизомеров образуются оптически неактивные смеси, получившие название рацемических. Они образуются, как правило, при химических синтезах без соблюдения специальных условий. Так, к примеру, рацемическая D,L-молочная кислота образуется из 2-хлорпропановой кислоты под действием водного раствора NaOH.

В ходе анаэробного гликолиза в организме из D-глюкозы образуется только L-молоч-ная кислота, так как процесс идет с участием ферментов. Разделение рацемических смесей на составляющие их оптически активные компоненты называются расщеплением. Для расщепления рацемических смесей используют механический, микробиологический, ферментативный, химический и другие методы.
Механический метод (метод Пастера). Этим методом в 1848 г. Луи Пастер разделил на оптически активные компоненты натрий-аммониевую соль винной кислоты. Суть этого метода заключается в том, что при определенной температуре компоненты рацемической смеси кристаллизуются в виде кристаллов, зеркально отличающихся своим строением. Если кристаллы достаточно большие (как в случае данной соли), то при помощи лупы или под микроскопом их можно механически отделить друг от друга. Затем кристаллы раздельно растворяют и определяют их оптическую активность. Это и осуществил Луи Пастер, получив оптически активные растворы из оптически неактивной рацемической смеси.
В настоящее время этот метод не используется и имеет историческое значение.
Микробиологический метод. Если питательной средой для выращиваемых микроорганизмов служит рацемическая смесь, то растущие микроорганизмы поглощают из нее
и усваивают лишь один из энантиомеров. Второй остается в питательной среде.
Ферментативный метод.Большинство ферментов способны различать и подвергать превращению лишь один из энантиомеров рацемической смеси. Так для разделения рацемической смеси аминокислот широко используют фермент ацилазу, выделяемую из почек свиней.
Химический методрасщепления рацемических смесей основан на переводе энантиомеров в диастереомеры, которые отличаются не только знаком оптического вращения, но и другими физическими свойствами — растворимостью, температурами кипения, плавления и т. д. Используя различия в этих свойствах, их и разделяют. Для превращения же энантиомеров в диастереомеры их переводят в соли путем взаимодействия с другими оптически активными соединениями. Так для разделения рацемических смесей соединений, содержащих кислотные группы, используют оптически активные основания — алкалоиды, выделяемые из растений. Если взять рацемическую смесь D,L-молочной кислоты и подвергнуть действию L-хинина, то образуются две соли:
1) остаток L-молочной кислоты* — L-хинин*;
2) остаток D-молочной кислоты* — L-хинин*.
Эти соли являются диастереомерами. Используя различия в физических свойствах этих солей, их отделяют друг от друга. Чистые энантиомеры молочной кислоты вытесняют из соли более сильной минеральной кислотой.
Из других современных методов следует выделить афинную хроматографию. Аффинная хроматография основана на способности биологически активных соединений взаимодействовать лишь с определенными веществами смеси и образовывать с ними нековалентные комплексы. Так, в биохимической практике при пропускании рацемической смеси через хроматографическую колонку с хиральным сорбентом выделяют белки (ферменты, иммуноглобулины, рецепторные белки).
СТЕРЕОИЗОМЕРИЯ МОЛЕКУЛ С ДВУМЯ ЦЕНТРАМИ ХИРАЛЬНОСТИ.
s-ДИАСТЕРЕОМЕРИЯ
 Наличие в молекуле двух центров хиральности предполагает существование 4-х стереоизомеров. Рассмотрим в качестве примера
Наличие в молекуле двух центров хиральности предполагает существование 4-х стереоизомеров. Рассмотрим в качестве примера
2-амино-3-гидроксибутановую кислоту (треонин).
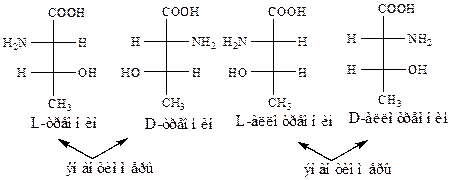 |
Правило «оксикислотный ключ». У гидрокси- и аминокислот, имеющих несколько хиральных центров, отношение к D- или L-ряду определяется по конфигурации верхнего хирального центра.
L-треонин и D-треонин, а также L-аллотреонин и D-аллотреонин являются энантиомерами (приставка алло- означает другой от греч. allos). Из представленных стереоизомеров только один входит в состав белков организма человека — L-треонин. В то же время пары L-треонин и D-аллотреонин, L-треонин и L-аллотреонин, D-треонин и D-аллотреонин, D-треонин и L-аллотреонин не являются зеркальным отображением друг друга и являются диастереомерами. Такиедиастереомеры называютs-диастереомерами,так как заместители связаны с центрами хиральности s-связями. Диастереомеры, в отличие от энантиомеров, обладают разными физическими и химическими свойствами.

Винная кислота (2,3-дигидроксибутандиовая, соли — тартраты) содержит 2 хиральных центра и должна иметь 4 стереоизомера. На самом деле винная кислота имеет 3 стереоизомера.
I II III IV

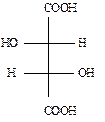


(+)D-винная кислота (–)L-винная кислота мезовинная кислота
III и IV стереоизомеры оказываются идентичными, их проекционные формулы совпадают при разрешенном повороте одной из них на 180º в плоскости бумаги и соответствуют одному и тому же соединению — мезовинной кислоте. Это объясняется тем, что у молекулы винной кислоты появляется плоскость симметрии. Мезовинная кислота не обладает оптической активностью.
Если сравнить пары изомеров I и III, II и III, то очевидно, что они являются диасте-реомерами.
Общему определению диастереомеров соответствуют известные цис- и транс-изомеры, характеризующиеся различным пространственным расположением заместителей относительно плоскости p-связи.
R,S-СИСТЕМА ОБОЗНАЧЕНИЯ КОНФИГУРАЦИИ
В 1961 году Каном, Ингольдом и Прелогом была предложена новая система стереохимической номенклатуры — R,S-номенклатура. Для обозначения конфигурации у асимметрического атома заместители рассматривают в порядке уменьшения их старшинства, определяемого их порядковым номером в периодической системе. Далее, модель молекулы располагают таким образом, чтобы заместитель с наименьшим старшинством (обычно водород), был удален от наблюдателя. Если при этом последовательность старшинства оставшихся трех заместителей уменьшается по часовой стрелке, то конфигурацию обозначают символом R (от лат. rectus — правый). Если же старшинство заместителей уменьшается против часовой стрелки, то центр хиральности получает символ S (от лат. sinister — левый).

 Например, бутанол-2, имеет следующий порядок старшинства заместителей:
Например, бутанол-2, имеет следующий порядок старшинства заместителей:
- ОН > - C2H5 > - CH3 > -H
Для того чтобы понять, почему группа C2H5 старше, чем группа CH3 необходимо рассмотреть порядковые номера элементов так называемого второго слоя, то есть тех элементов, которые непосредственно не связаны с центром хиральности. У группы C2H5 во втором слое Н, Н и С, а у группы CH3 — Н, Н, Н. Поскольку порядковый номер у атома углерода больше, чем у водорода, то старшинство этильной группы выше.
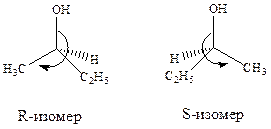
Если молекула содержит несколько центров хиральности, то их конфигурацию определяют по каждому из центров.
ВЗАИМОСВЯЗЬ СТЕРЕОХИМИЧЕСКОГО СТРОЕНИЯ
И БИОЛОГИЧЕСКОЙ АКТИВНОСТИ
 |
 Большинство метаболитов являются хиральными молекулами. В процессах обмена в клетке участвуют L-молочная, L-яблочная кислоты, L-аминокислоты, D-сахара. Хиральными молекулами являются белки, построенные из L-аминокислот, фосфолипиды, витамины, гормоны, нуклеиновые кислоты. Стереоизомерия лежит в основе специфичности взаимодействия субстрат-фермент, гормон-рецептор, антиген-антитело и др. Фармакологическое действие ряда лекарственных веществ обусловлено их взаимодействием с рецепторами клетки. Например, из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет левовращающий адреналин. У правовращающего адреналина ОН группа у хирального центра ориентирована иначе и не взаимодействует с рецептором. Причиной такой специфичности взаимодействий является комплементарность — взаимное соответствие дополняющих друг друга структур.
Большинство метаболитов являются хиральными молекулами. В процессах обмена в клетке участвуют L-молочная, L-яблочная кислоты, L-аминокислоты, D-сахара. Хиральными молекулами являются белки, построенные из L-аминокислот, фосфолипиды, витамины, гормоны, нуклеиновые кислоты. Стереоизомерия лежит в основе специфичности взаимодействия субстрат-фермент, гормон-рецептор, антиген-антитело и др. Фармакологическое действие ряда лекарственных веществ обусловлено их взаимодействием с рецепторами клетки. Например, из двух энантиомеров адреналина наибольшую фармакологическую активность проявляет левовращающий адреналин. У правовращающего адреналина ОН группа у хирального центра ориентирована иначе и не взаимодействует с рецептором. Причиной такой специфичности взаимодействий является комплементарность — взаимное соответствие дополняющих друг друга структур.
Таким образом, биологическое действие биологически активных веществ и лекарственных средств тесно связано с их пространственным строением.
|
из
5.00
|
Обсуждение в статье: Малые циклы (циклопропан и циклобутан) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

