 |
Главная |
Принципы R,S-номенклатуры
|
из
5.00
|
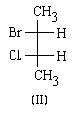
Основные этапы процедуры наименования абсолютной конфигурации рассмотрим на примере энантиомеров бромфторхлорметана (12) и (13).
Первым этапом является определение порядка старшинства заместителей при асимметрическом атоме.
| СТАРШИНСТВО АТОМА данного элемента задается его порядковым номером в Периодической таблице Д.И. Менделеева. Чем больше порядковый номер элемента, тем старше атом. |
Старшинство изотопов данного элемента возрастает с увеличением их массового числа.
В соответствии с этим, имеем следующий порядок старшинства заместителей в молекулах бромфторхлорметанов:
Br > CI> F> Н
Самый старший заместитель обозначим буквой а, следующий по старшинству - буквой b и т.д. (то есть, при переходе а  b
b  c
c  d старшинство убывает):
d старшинство убывает):

Второй этап. Располагаем молекулу таким образом, чтобы самый младший заместитель был удален от наблюдателя (при этом он будет заслонен атомом углерода) и рассматриваем молекулу вдоль оси связи углерода с младшим заместителем:

Третий этап. Определяем, в каком направлении ПАДАЕТ старшинство заместителей, находящихся в нашем поле зрения. Если падение старшинства происходит по часовой стрелке, обозначаем буквой R (от латинского "rectus"правый). Если старшинство падает против часовой стрелки, то конфигурацию обозначаембуквой S(от латинского "sinister"-левый).
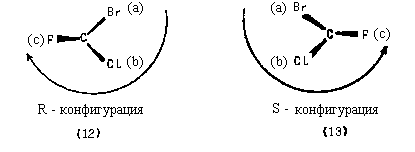
Существует также мнемоническое правило, в соответствии с которым падение старшинства заместителей в R-изомере происходит в том же направлении, в котором пишется верхняя часть буквы R, а в S-изомере - в том же направлении, в котором пишется верхняя часть буквы S :

Теперь мы можем написать полные названия энантиомеров, которые однозначно говорят об их абсолютной конфигурации:
| (R)-бромфторхлорметан | (S)-бромфторхлорметан |
| (12) | (13) |
Следует подчеркнуть, что обозначение конфигурации стерзоизомера как R или S зависит от порядка старшинства всех четырех заместителей при асимметрическом атоме. Так, в изображенных ниже молекулах пространственное расположение атомов F, CI и Вг относительно группы X одинаково:

Однако, обозначение абсолютной конфигурации этих молекул может оказаться одинаковым или разным. Это определяется природой конкретной группы X.
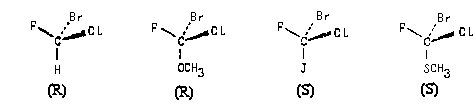
В ряде химических реакция пространственное расположение заместителей у асимметричеекого атома углерода может измениться, например:
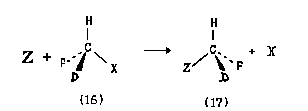
В молекулах (16) и (17) пространственное расположение атомов Н, D (дейтерий) и F относительно заместителей X и Z зеркально противоположно:

Поэтому говорят, что в данной реакции произошло обращение конфигурации.
Обозначение абсолютной конфигурации, определенное по системе Кана-Ингольда-Прелога, при переходе от (16) к (17) может измениться или остаться прежним. Это зависит от конкретных групп X и Z, влияющих на порядок старшинства заместителей при асимметрическом атоме, например:

В приведенных примерах нельзя говорить об обращении абсолютной конфигурации, поскольку исходное соединение и продукт реакции не являются изомерами (см. выше, стр.20). В то же время, превращение одного энантиомера в другой - это обращение абсолютной конфигурации:
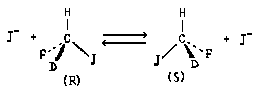
VI.Молекулы с двумя асимметрическими атомами.
Диастереомеры.
Если в молекуле есть несколько асимметрических атомов, появляются особенности в построении проекций Фишера, а также новый тип взаимоотношений между стереоизомерами, которого нет в случае молекул с одним
асимметрическим атомом.
Рассмотрим принцип построения проекций Фишера для одного из стереоизомеров 2-бром-З-хлорбутана.

Запись в скобках (2S,3S) означает, что атом углерода с номером 2 имеет S-конфигурацию. То же относится к атому углерода с номером 3. Нумерация атсмов в молекуле производится в соответствии с правилами ИЮПАК для наименования органических соединений.
Асимметрическими атомами в этой молекуле являются атомы углерода С(2) и С(3). Поскольку данная молекула может существовать в различных конформациях относительно центральной связи С-С, необходимо условиться, для какой конформации мы будем строить проекциюФишера. Следует запомнить, что проекция Фишера строится только для заслоненной конформации, причем такой, в которой атомы С, составляющие углеродную цепочку молекулы, располагаются в одной плоскости.
Переведем изображенную выше молекулу в заслоненную конформацию и развернем ее таким образом, чтобы углеродная цепочка была расположена вертикально. Полученная при этом клиновидная проекция соответствует такому расположению молекулы, при котором все связи С-С находятся в плоскости чертежа:
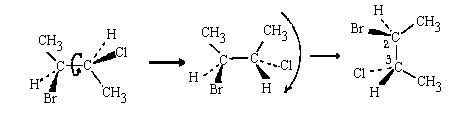
Повернем всю молекулу на 90°относительно центральной связи С-С, не изменяя ее конформацию так, чтобы CН3-группы ушли под плоскость чертежа. При этом атомы Br, CI и связанные с С(2) и С(3) атомы водорода окажутся над плоскостью чертежа. Спроектируем ориентированную таким образом молекулу на плоскость чертежа (атомы, находящиеся под плоскостью проектируем вверх; атомы, расположенные над плоскостью - вниз) аналогично тому, как мы делали это в случае молекулы с одним асимметрическим атомом:
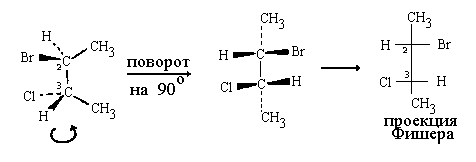
В полученной таким образом проекции подразумевается, что лишь центральная связь С-С лежит в плоскости чертежа. Связи С(2)-CН3 и C(3)-CН3 направлены от нас. Связи атомов С(2) и С(3) с атомами Н, Вr и CI направлены к нам. Атомы С(2) и С(3) подразумеваются в точках пересечения вертикальной и горизонтальных линий. Естественно, что при пользовании полученной проекцией необходимо соблюдать изложенные выше правила (см.правила).
Для молекул о несколькими асимметрическими атомами число стереоизомеров равно в общэм случае 2n, где n - число асимметрических атомов. Следовательно, для 2-бром-З-хлорбутана должны существовать 22 - 4 стереоизомера. Изобразим их с помощью проекций Фишера.
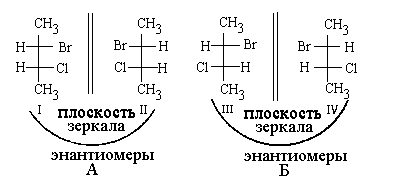
Эти стереоизомеры можно подразделить на две группы: А и Б. Изомеры А (I и П) связаны операцией отражения в зеркальной плоскости - это энантиомеры (антиподы). То же самое относится к изомерам группы Б: Ш и IV - также энантиомеры.
Если же мы сравним любой из стереоизомеров группы А с любым стереоизомером группы Б, то обнаружим, что они не являются зеркальными антиподами.
| Пространственные изомеры, не являющиеся энантиомерами по отношению друг к другу, называются ДИАСТЕРЕОМЕРАМИ |
Таким образом, I и Ш - диастереомеры. Аналогично, диастереомерами являются по отношению друг к другу I и IV, II и III, II и IV.


Могут реализоваться случаи, когда число изомеров меньше предсказываемого формулой 2n. Такие случаи встречаются, когда окружение центров хиральности создается одним и тем же набором атомов (или групп атомов), например, в молекулах 2,3-дибромбутанов:
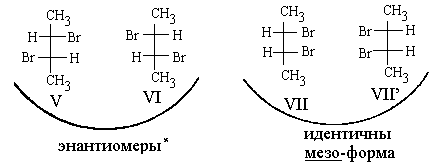
(*Молекулы V и VI хиральны, поскольку в них отсутствуют элементы симметрии группы Sn. Однако, и в V и в VI есть простая поворотная ось симметрии С2, проходящая через середину центральной связи С -С, перпендикулярная плоскости чертежа. На этом примере видно, что хиральные молекулы не обязательно асимметричны).
Нетрудно видеть, что проекции VII и VII' изображают одно и то же соединение: эти проекции полностью совмещаются друг с другом при повороте на 180° в плоскости чертежа. В молекуле VII легко обнаруживается плоскость симметрии, перпендикулярная центральной С-С-связи и проходящая через ее середину. В данном случае в молекуле есть асимметричекие атомы, но в целом молекула ахиральна. Соединения, состоящие из таких молекул, называются мезо-формами. Мезо-форма не способна вращать плоскость поляризации света, то есть она оптически неактивна.
Согласно определению, любой из энантиомеров (V) и (VI) и мезо-форма являются по отношению друг и другу диастереомерами.
Как известно, физические свойства энантиомеров идентичны (за исключением отношения к плоскополяризованному свету). Иначе обстоит делос диастереомерами, поскольку они не являются зеркальными антиподами. Их физические свойства отличаются так же, как свойства структурных изомеров. Ниже это показано на примере винных кислот.
| Винные кислоты | |||

| 
| ||
[  ]D20 ]D20
| +11,58о | -11,58о | 0о |
| т.пл.,°С | |||
| растворимость в 100 г воды (18°) | 139 г | 139 г | 125 Г |
VII Относительная конфигурация. Эритро-трео-обозначения.
В отличие от понятия "абсолютная конфигурация", термин "относительная конфигурация" используется, по крайней мере, в двух аспектах. Так, под относительной конфигурацией понимается структура соединения, определенная по отношению к некоторой "ключевой" модели путем химических переходов. Таким путем в свое время была определена конфигурация асимметрических атомов в молекулах углеводов по отношению к глицериновому альдегиду. При этом рассуждали примерно так: "Если (+)-глицериновый альдегид имеет изображенную ниже конфигурацию, то связанный с ним химическими превращениями углевод имеет такую-то конфигурацию асимметрических атомов".

Позже, когда был разработан рентгенографический метод определения абсолютной конфигурации, было показано, что в данном случае догадка о том, что (+)-глцериновый альдегид имеет изображенную конфигурацию, верна. Следовательно, верно и отнесение конфигураций асимметрических атомов в углеводах.
Термин "относительная конфигурация" имеет и другое значение. Его используют при сравнении диастереомеров по различиям во взаимном расположении выбранных групп внутри каждого диастереомера. Именно в этом плане об относительной конфигурации говорится в номенклатурных правилах ИЮПАК по химии. Рассмотрим два способа обозначения относительной конфигурации (взаимного расположения групп внутри молекулы) диастереомеров с асимметрическими атомами [существуют диастереомеры без асимметрических атомов, например, цис-и транс-алкены (см. ниже, стр. 52)] на примере стереоизомеров 2-бром-3-хлорбутана (1)-(1V).
В первом варианте используются конфигурационные дескрипторы эритро- и трео-. При этом сравнивают расположение одинаковых заместителей при двух асимметрических атомах в проекции Фишера. Стереоизомеры, в которых одинаковые заместители при асимметрических атомах углерода расположены по одну сторону от вертикальной линии, называют эритро-изомерами. Если такие группы находятся по разнне стороны от вертикальной линии, то говорят о трео-изомерах. В соединениях (I) -(IV) такими реперными -группами являются атомы водорода, и эти соединения получают следующие названия:

Отсюда видно, что обозначение относительной конфигурации у энантиомеров совпадает, а у диастереомеров - различается. Это важно, поскольку и в настоящее время установление абсолютной конфигурации энантиомеров - задача непростая. В то же время, различить диастереомеры достаточно легко, например, с помощью спектров ЯМР. При этом фраза "Из спектра следует, что в результате реакции получается эритро-2-бром-3-хлорбутан" означает, что речь идет об одном из энантиомеров: (I) или (II) [либо о рацемате, состояшем из (I)и (П)] (о каком именно - неизвестно), но не о соединениях (Ш) или (IV). Аналогично, фраза "Мы имеем дело с трео-2-бром-3-хлорбутаном" означает, что имеются в виду соединения (Ш) и (IV), но не (I) или (П).
Запомнить эти обозначения можно, например, так. В эритро-изомере одинаковые заместители "смотрят" в одну сторону, как и элементы буквы "а".
Приставки эритро- и трео- происходят от названий углеводов: треозы и эритрозы. В случае соединений с болтшим числом асимметрических атомов применяют другие стереохимические дескрипторы, такжне происходящие от названий углеводов (рибо-, ликсо-, глюко- и т.п.).
В другой варианте обозначения относительной конфигурации испольмуют символы R* и S* При этом асимметрический атом, имеющий наименьший номер (в соответствии с правилами номенклатуры ИЮПАК), независимо от его абсолютной конфигурации, получает дескриптор R*. В случае соединений (I) - (IV) - это атом углерода, связанный с бромом. Второму асимметрическому атому в данной молекуле также придается дескриптор R*, если обозначения абсолютной конфигурации обоих асимметрических атомов совпадают (оба R или оба S).Так следует поступить в случае молекул (Ш) и (IV). Если же абсолютная конфигурация асиммотрических атомов в молекуле имеет разное обозначение (молекулы I и II), то второй асимметрический атом получает дескриптор S*
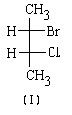
| 
| 
| 
| |
| абсолютная конфигурация | (2S,3R) | (2R,3S) | (2S,3S) | (2R,3R) |
| относительная конфигурация | (2R*,3S*) | (2R*,3S*) | (2R*,3R*) | (2R*,3R*) |
Эта система обоэначения относительной конфигурации, по существу, эквивалентна в эритро-трео-системе обозначений: у энантиомеров обозначения совпадают, а у диастереомеров - различаются. Разумеется, если у асимметрических атомов нет одинаковых заместителей, то относительную конфигурацию можно обозначить только с помощью дескрипторов R* и S*
VIII Методы Разделения энантиомеров.
Природные вещества, молекулы которых хиральны, являются индивидуальнымиэнантиомерами. Если же хиральный центр возникает в процессе химическойреакции, проводимой в колбе или промышленном реакторе,получается рацемат, содержащий равные количества двух энантиомеров. При этом возникает проблема разделения энантиомеров с целью получения каждого из них в индивидуальном состоянии. Для этого используют специальные приемы, называемые методами расщепления рацематов.
Метод Пастера.
Л.Пастер в 1848 г. обнаружил, что из водных растворов натриево-аммониевой соли виноградной кислоты (рацемат (+)- и (-)-винных кислот) при определенных условиях выпадают кристаллы двух типов, отличающиеся друг от друга как предмет и его зеркальное отображение. Пастер разделил эти кристаллы с помощью микроскопа и пинцета и получил в чистом виде соли (+)-винной кислоты и (-)-винной кислоты. Такой метод расщепления рацематов, основанный на самопроизвольной кристаллизации энантиомеров в двух различных кристаллических модификациях, получил название "метод Пастера". Однако, этот метод удается применить далеко не всегда. В настоящее время известно около 300 пар энантиомеров, способных к такой "самопроизвольной кристаллизации" в виде кристаллов разной формы. Поэтому были разработаны другие методы, позволяющие разделять энантиомеры.
|
из
5.00
|
Обсуждение в статье: Принципы R,S-номенклатуры |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

