 |
Главная |
Главное квантовое число
|
из
5.00
|
Лекция № 36
Тема № 13Атомная физика
Занятие № 13/5Строение атома
Тольятти 2007
Тольяттинский военный технический институт
Кафедра «Математика и физика»
Н.А. Леонова
У Т В Е Р Ж Д А Ю
Заведующий кафедрой
к.э.н А. Баранов
«___» ________ 200_ г.
Дисциплина «Физика»
Лекция № 36
Тема № 13Атомная физика
Занятие № 13/5Строение атома
Обсуждено на заседании
кафедры «__» ______ 200__ г.
Протокол № ___
Тольятти 2007
Содержание
Цель занятия:Рассмотреть квантовомеханическую природу атома водорода
Введение
Основная часть
Вопросы: 1. Квантовомеханическая модель атома водорода.
2. Спин электрона.
3. Принцип Паули.
4. Периодические законы Менделеева.
Выводы
Список используемой литературы
1. Савельев И.В. «КФ» т. 3 стр. 86-122
2. Трофимова Т.М. «КФ» стр. 303-422
Наглядные пособия
1. Электронные слайды
2. Плакаты
Введение
После открытия волновых свойств вещества стало совершенно ясно, что теория Бора, опирающаяся на классическую механику, могла быть только переходным этапом на пути к созданию последовательной теории атомных явлений.
Квантовомеханическая модель атома водорода
Простейшим атомом является атом водорода (водородоподобным являются: ионы гелия Не+, двукратно ионизированного лития Li++)
Потенциальная энергия взаимодействия
 |
 , где r – расстояние между электроном и ядром.
, где r – расстояние между электроном и ядром.
Состояние электрона в атоме водорода описывается волновой функцией.  , где m – масса электрона Е – полная энергия электрона в атоме.
, где m – масса электрона Е – полная энергия электрона в атоме.
 (n = 1, 2, 3….)
(n = 1, 2, 3….)
Е1 – основной уровень (минимальный) все остальные Еn – возбужденные.
Е<0 движение электрона является связанным – он находится внутри «потенциальной ямы».
Е>0 – соответствует ионизированному атому.
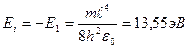
Спин электрона
В квантовой механике состояние электрона в атоме описывается тремя числами.
Главное квантовое число
n – определяет электрические уровни электрона в атоме и может принимать любые целочисленные значения
n = 1, 2, 3
Момент импульса электрона квантуется, т.е. не может быть произвольным, а принимает дискретные значения.
 , где
, где  - орбитальное, квантовое число, которое при заданном n принимает значения
- орбитальное, квантовое число, которое при заданном n принимает значения  = 0, 1,…, (n-1) всего n – значений определяет момент импульса электрона в атоме.
= 0, 1,…, (n-1) всего n – значений определяет момент импульса электрона в атоме.
Из решения уравнений Шредингера следует, что вектор  момента импульса может иметь лишь такие ориентации в пространстве, при которых его проекция Liz на направлении z внешнего магнитного поля принимает квантовые значения, кратные h.
момента импульса может иметь лишь такие ориентации в пространстве, при которых его проекция Liz на направлении z внешнего магнитного поля принимает квантовые значения, кратные h.
Liz=hm  , где m
, где m  - магнитные квантовые числа
- магнитные квантовые числа
m  =0, ± 1, ± 2, …, ±
=0, ± 1, ± 2, …, ±  всего 2
всего 2  + 1.
+ 1.
Магнитное квантовое число m  определяет проекцию момента импульса электрона на заданное направление.
определяет проекцию момента импульса электрона на заданное направление.
При движении электрона в атоме существенны волновые свойства электрона согласно квантовой механике, каждому энергетическому состоянию соответствует волновая функция квадрат модуля которой определяет вероятность обнаружение электрона в единице объема.
Вероятность обнаружения электрона в единице объема различна. Электрон при своем движении как бы «размазан» по всему объему, образуя электронное облако, плотность которого характеризует вероятность нахождения электрона в различных точках объема атома.
 |
Квантовые числа n и
 характеризуют размер и форму электронного облака, а квантовое число mi характеризует ориентацию электронного облака в пространстве.
характеризуют размер и форму электронного облака, а квантовое число mi характеризует ориентацию электронного облака в пространстве.
О.Штерн и В.Герлах проводя прямые измерения магнитных моментов обнаружили что, пучок атомов водорода, заведомо находящихся в S – состояние, в неоднородном магнитном поле расщепляется на два пучка. Для объяснения выдвинули гипотезу о том, что электрон обладает собственным моментом импульса не связанными с движением электрона в пространстве. Этот собственный момент был назван спином.
«Спин» по английски «верчение». Спин следует считать внутренним свойством, присущим электрону подобному тому как ему присущ заряд или масса. Спин квантуется по закону
 , где S – спиновое квантовое число
, где S – спиновое квантовое число
Принцип Паули
В системе одинаковых фермионов Любые два из них не могут одновременно находится в одном и том же состоянии.
Фермионы – частицы с полуцелым спином (электроны, протоны, нейтроны)
Бозоны – частицы с нулевым или целочисленным спином (  - мезоны, фотоны).
- мезоны, фотоны).
Распределение электрона в атоме подчиняется принципу Паули.
В одном и том же атоме не может быть более одного электрона с одинаковым набором четырех квантовых чисел n,  , m
, m  , ms
, ms
главное квантовое число n (1, 2, 3, ….)
орбитальное  (
(  = 0, 1, 2, …, n-1)
= 0, 1, 2, …, n-1)
магнитное 
магнитное спиновое mS (ms = +  )
)
Совокупность электронов в многоэлектронном атоме, имеющих одно и тоже главное квантовое число n, называют электронной оболочкой. В каждой из оболочек электроны распределяются по подоболочкам.
|
из
5.00
|
Обсуждение в статье: Главное квантовое число |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

