 |
Главная |
Взаимодействие со щелочами
|
из
5.00
|
В растворах щелочей также протекает реакция диспропорционирования:

Восстановительные свойства
Сильные окислители превращают фосфор в фосфорную кислоту:


Реакция окисления фосфора происходит при поджигании спичек, в качестве окислителя выступает бертолетова соль:

Токсикология элементарного фосфора
· Красный фосфор практически нетоксичен (токсичность ему придают примеси белого фосфора). Пыль красного фосфора, попадая в легкие, вызывает пневмонию при хроническом действии.
· Белый фосфор очень ядовит, растворим в липидах. Смертельная доза белого фосфора — 50—150 мг. Попадая на кожу, тлеющий белый фосфор даёт тяжелые ожоги.
2) Степень окисления: -3 до +5
Р образует наиболее прочные связи с F и О
4) Фосфи́ды — бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления.
Получение
Большинство фосфидов представляют собой соединения фосфора с типичными металлами, которые получаются прямым взаимодействием простых веществ:
Na + P(красн.) → Na3P + Na2P5 (200 °C)
Фосфид бора можно получить как прямым взаимодействием веществ при температуре около 1000 °C, так и реакцией трихлорида бора с фосфидом алюминия:
BCl3 + AlP → BP + AlCl3 (950 °C)
Химические свойства
Фосфиды металлов — неустойчивые соединения, которые разлагаются водой и разбавленными кислотами. При этом получается фосфин и, в случае гидролиза, — гидроксид металла, в случае взаимодействия с кислотами — соли.
Ca3P2 + 6H2O → 3Ca(OH)2 + 2PH3
Ca3P2 + 6HCl → 3CaCl2 + 2PH3
При умеренном нагревании большинство фосфидов разлагаются. Плавятся под избыточным давлением паров фосфора.
Фосфид бора BP, наоборот, тугоплавкое (tпл. 2000 °C, с разложением), весьма инертное вещество. Разлагается только концентрированными кислотами-окислителями, реагирует при нагревании с кислородом, серой, щелочами при спекании.
4) Кислоты фосфора
Фо́сфорные кисло́ты — соединения фосфора в степени окисления +5, имеющие общую формулу P2O5·nH2O.
При взаимодействии высшего оксида фосфора с водой на холоде получается метафосфорная кислота HPO3, представляющая собой прозрачную стекловидную массу. При разбавлении её водой образуется ортофосфорная кислота H3PO4:

При нагревании до 200—250 °C ортофосфорная кислота обезвоживается, и образуется пирофосфорная кислота H4P2O7, в результате дальнейшей дегидратации которой при 400—500 °C вновь образуется метафосфорная кислота:

Из всех фосфорных кислот наибольшее практическое значение имеет ортофосфорная кислота[1] (которую часто называют просто фосфорная[2]). Для её получения используют реакции обмена фосфатов с сильными кислотами или окисление белого фосфора азотной кислотой:
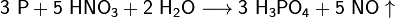
|
из
5.00
|
Обсуждение в статье: Взаимодействие со щелочами |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

