 |
Главная |
Обусловлены наличием гидроксогруппы
|
из
5.00
|
ГАОУ СПО «Брянский базовый медицинский колледж»
МЕТОДИЧЕСКАЯ РАЗРАБОТКА
ДЛЯ ПРЕПОДАВАТЕЛЯ
Учебная дисциплина: Органическая химия
Тема: «Спирты»
Вид занятия: лекционное
Количество часов: 2 часа (90 минут)
Курс: 2
| Автор:преподаватель химии Петракова Е.А |
| Рассмотрена на заседании методической комиссии по специальности «Фармация» «10» октября 2013г. Протокол № 3 Председатель ___________ С.Н.Алексеева Рекомендована методическим советом «___» ___________г. Протокол № | Утверждаю Зам. директора ГАОУ СПО «Брянский базовый медицинский колледж» ___________________М.А. Захарова « » _________________г |
Методическая разработка лекционного занятия для преподавателя по теме: «Спирты.»составлена в соответствии с рабочей программой по учебной дисциплине «Органическая химия» дляспециальности 060301 «Фармация»
Автор: преподаватель химии Петракова Е.А.ГАОУ СПО «Брянский базовый медицинский колледж»
Рецензенты:
Технологическая карта лекционного занятия
| № этапа занятия | Содержание этапа занятия | Количество минут |
| Организационный момент | ||
| Озвучивание темы занятия «Спирты»,актуальность, постановка цели, внутридисциплинарные, междисциплинарные связи, план лекции: 1. Классификация спиртов. Гомологический ряд предельных одноатомных спиртов. Радикало – функциональная и заместительная номенклатура спиртов. Способы получения одноатомных спиртов. 2. Межмолякулярная водородная связь. Химические свойства: кислотно – основные свойства, реакции нуклеофильного замещения, дегидратации, окисления, восстановления. Сравнительная характеристика одноатомных и многоатомных спиртов. Этанол, глицерин. | ||
| Изложение материала по плану | ||
| Закрепление | ||
| Подведение итогов. Ответы на вопросы студентов | ||
| Домашнее задание Конспект лекции , параграф 8.2учебник: Зурабян С.Е. Лузин А.И.Органическая химия: учебник /Под.ред. проф. И.А.Тюкавкиной - М.: ГЭОТАР-Медиа, 2012. – 384 с. |
Цели:
Образовательная:Дать полное представление о гомологическом ряде, химическом и электронном строении, изомерии и номенклатуре алканов и алкенов. Рассмотреть особенности получения и отличительные свойства соединений данных классов.
В результате изучения темы «Введение» обучающийся должен:
знать/понимать:
- свойства алканов и алкенов
- способы получения
- правила составления названий
На основе использования теоретических знаний уметь:
- прогнозировать направление протекания реакций,
- устанавливатьприроду и свойства веществ
Воспитательная:воспитание ответственного отношения к использованию химических веществ в лаборатории, быту, медицинских учреждениях с соблюдением техники безопасности.
Развивающая: использовать приобретенные знания и умения в практической деятельности и повседневной жизни для:
- определения возможности протекания химических превращений в различных условиях и оценки их последствий;
- распознавания и идентификации важнейших дезинфицирующих и лекарственных веществ и материалов.
Внутридисциплинарные связи:Рассмотрение темы в свете учения А.М. Бутлерова.
Междисциплинарные связи:Оптическая изомерия доказывается физическими методами, связь с фармтехнологией (алканы, алкены как сырье).
Оснащение: методическая разработка для преподавателя, электронная презентация, шаро-стержневые модели.
Использованная литература:
1. Н.А. Тюкавкина. Органическая химия.- М.: «ГЭОТАР Медиа»,2011
2. Зурабян С.Е. Лузин А.И.Органическая химия: учебник /Под.ред. проф. И.А.Тюкавкиной - М.: ГЭОТАР-Медиа, 2012. – 384 с.
План лекции:
1. Классификация спиртов. Гомологический ряд предельных одноатомных спиртов. Радикало – функциональная и заместительная номенклатура спиртов. Способы получения одноатомных спиртов.
2. Межмолякулярная водородная связь. Химические свойства: кислотно – основные свойства, реакции нуклеофильного замещения, дегидратации, окисления, восстановления. Сравнительная характеристика одноатомных и многоатомных спиртов. Этанол, глицерин.
1.
Спирты относятся к классу гидроксопроизводных – органические соединения, в составе которых имеется гидроксильная группа –ОН. Гидроксогруппа характерна для двух классов: спирты и фенолы.
В фенолах гидроксогруппа связана с sp2 – гибридным атомом углерода кольца и обладает особыми свойствами.
В спиртах ОН связана с sp3 – гибридным атомом углерода. Все спирты можно классифицировать по следующим признакам:
1) по количеству гидроксо-групп, входящих в состав соединения различают одно-, двух - , трех- и многоатомные спирты.
2) по строению УВ остатка: предельные, непредельные, алициклические, ароматические.
Одноатомные предельные спирты.
Производные алканов, в которых 1 атом Н замещен на гидроксогруппу СnH2n+1OH
Для них характерна структурная изомерия, обусловленная дибо строением углеродного скелета, либо положением функциональной группы в цепи. В связи с этим, одноатомные предельные спирты делятся на первичные, вторичные, третичные, в зависимости от того, с каким атомом С свзана ОН – группа. Также для спиртов характерна оптическая изомерия.
Номенклатура.
1) Радикально – функциональная: УВ остаток + -овый спирт
2) ИЮПАК: если – ОН характеристическая группа - + ол, если есть старшие функциональные – преффикс гидрокси – с указанием локанта.
3) Карбинольная: радикал + карбинол ( СН2ОН)
4) Тривиальная
Способы получения.
1. Гидролиз галогенпроизводных (SN)

2. Гидратация алкенов (АЕ)
СН2 = СН2 + НОН → СН3СН2ОН ( кат Н2SО4)
3. Гидролиз сложных эфиров
СН3 – С = О
│
О – СН3 + Н2О → СН3 – СООН + СН3ОН
4. Каталитическое гидрирование альдегидов, кетонов, сложных эфиров
5. Использование металорганических соединений (АN)
СН3МgI + HCOH→ CH3CH2 – O - MgI  СН3СН2ОН
СН3СН2ОН
Физические свойства
Спирты – бесцветные вещества.
С1-С11 - жидкости, остальные твердые вещества. Низшие спирты имеют характерный алкогольный запах, жгучий вкус. Спирты количесвтом атомов С 1-3 смешиваются с водой в любых соотношениях, с увеличением Мr массы и разветвленности структуры, растворимость в воде падает. Температура кипения и плавления спиртов выше, чем у соответствующих алканов, что объясняется тем, что молекулы спиртов ассоциированы. Связана ассоциация с возникновение межмолекулярных водородных связей, в результате электростатического притяжения частично «+» атома водорода и «–« атома О соседних молекул. Эта связь возникает между молеклами спирта и воды, чем объясняется очень хорошая растворимость низших спиртов. По мере усложнения УВ остатка водородная связь ослабевает.
Химические свойства
Обусловлены наличием гидроксогруппы
Полярность связи О-Н, дает проявление кислотных свойств спиртами. Полярная связь С-О также способна разрываться гетеролитически. Атом углерода, связанный с гидроксильной группой, может выступать в роли электрофильного центра и, следовательно, подвергаться нуклеофильной атаке. Это означает, что для спиртов возможно протекание реакций нуклеофильного замещения.
В то же время наличие в молекуле спирта атома кислорода, имеющего неподеленные пары электронов, предопределяет проявление спиртами свойств оснований. По той же причине спирты способны выступать в роли нуклеофильных реагентов по отношению к другим соединениям.

Кислотные свойства.


Основные свойства.
Кислотные свойства спиртов убывают в следующем порядке: первичные > вторичные > третичные. Это связано с увеличением положительного индуктивного эффекта алкильных групп от первичных к третичным, которые | повышают электронную плотность на атоме углерода, тем самым ослабляя поляризацию связи Н-О и препятствуя отщеплению положительно заряженного водорода.
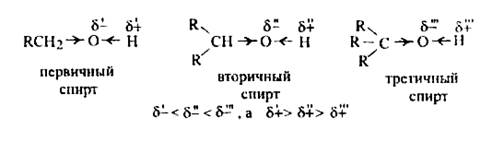
Основные свойства алканолов проявляются в их взаимодействии с кислотами. При этом спирты, подобно воде, дают соли оксония. Так, взаимодействие метанола с бромистым водородом при низкой температуре приводит к образованию бромида метилоксония (по донорно-акцепторной схеме), который при нагревании отщепляет молекулу воды и превращается в галогенопроизводное.

Благодаря основным свойствам спирты способны к обрати комплексных соединений с солями некоторых металлов.
Основные свойства спиртов изменяются в порядке, обратном изменению кислотности. Чем больше электронной плотности концентрируется на кислорода функциональной группы, тем легче к нему присоединяется положительный ион водорода.
Реакция этерификации – взаимодействие с карбоновыми и минеральными кислотами, в результате чего образуются сложные эфиры.

|
Эфиры ортофосфорной кислоты

|
Взаимодействие с органическими кислотами. Спирт выступает в роли нуклеофила:
1 стадия – присоединение протона водорода к атому кислорода карбоксильной группы с образованием карбокатиона.
2 стадия – присоединение к положительному центру атома кислорода гидроксильной группы с последующим отщеплением воды.
3 стадия – вывод катализатора – протона водорода, с образованием простого эфира.
|
из
5.00
|
Обсуждение в статье: Обусловлены наличием гидроксогруппы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

