 |
Главная |
Загрязнение атмосферы соединениями азота
|
из
5.00
|
Оксиды азота играют ключевую роль в образовании фотохимического "смога" (см. соответствующую лекцию), влияют на разрушение озонового слоя (см. соответствующую лекцию). В силу этого обстоятельства загрязнение атмосферы оксидами азота оказывает как локальные, так и глобальные эффекты на состояние окружающей среды.
Загрязнение атмосферы оксидами азота в целом сравнительно невелико. Однако в районах с развитой химической промышленностью, в частности в окрестностях заводов по производству азотной кислоты, имеются локальные зоны повышенного содержания NO, NO2 в воздухе.
Соединения азота в тропосфере представлены в основном оксидами азота, аммиаком и солями аммония, а также азотной кислотой и нитратами. Среди оксидов азота следует выделить оксид диазота (N2О), монооксид (NO) и диоксид азота (N02). Другие соединения азота с кислородом (N03, N2O3, N2O4, N2O5) в условиях тропосферы являются неустойчивыми. Так, например, триоксид диазота и тетраоксид диазота легко разлагаются с образованием NO и NO2:
N203 + hn ® NO + N02
N204 + hn ® 2N02
Триоксид азота сравнительно быстро подвергается фотодиссоциации или вступает во взаимодействие с другими примесями:
N03 + hn ® NO + 02
N03 + NO ® 2N02
Пентаоксид диазота также является неустойчивым в тропосфере соединением и разлагается с образованием триоксида диазота и кислорода или под действием влаги превращается в азотную кислоту:
N205 ® N2O3 + 02
N205 + Н20 ® 2HN03 (1)
Поэтому под общей формулой оксидов азота NOx обычно подразумевают NO, N02 и N20.
Среднее значение концентрации оксида диазота в тропосфере незначительно меняется с высотой над уровнем моря и географической широтой местности и составляет в среднем, по данным различных авторов, 0,26 или 0,33 млн-1.
Общее количество оксида диазота, поступающего в атмосферу в основном в результате протекания процессов денитрификации (эти процессы протекают при помощи почвенных микроорганизмов), составляет примерно 100 млн т в год. Общее количество N20 в атмосфере оценивается величиной 2000 млн т, таким образом, среднее время пребывания молекул оксида диазота в атмосфере составляет 20 лет.
Основные процессы вывода N20 из атмосферы связывают с протеканием процессов фотодиссоциации:
N20 + hn ® N2 + О, l £ 250 нм
или с взаимодействием с синглетно возбужденным атомом кислорода:
N20 + 0(1D) ® N2 + 02
N20 + 0(1D) ® 2NO
Две последние реакции протекают с примерно одинаковой скоростью. Поскольку в тропосфере концентрация синглетно возбужденных атомов кислорода является низкой и практически нет излучения с длиной волны l £ 250 нм, молекулы N2О обладают большим временем жизни и могут переместиться в стратосферу. В стратосфере в связи с ростом концентрации 0(1D) атомов и изменением спектра проходящего солнечного излучения скорость процессов разрушения молекул N2О резко возрастает. Поэтому концентрация N2О на высоте 35 км примерно в 10 раз меньше, чем в тропосфере.
Оксид и диоксид азота в тропосфере подвергаются взаимным превращениям. Как известно. N0 в присутствии кислорода окисляется до N02. Расчеты показывают, что в равновесных условиях концентрация диоксида азота примерно в 100 раз должна превышать содержание NO. Поэтому долгое время при анализе атмосферы на содержание оксидов азота определяли только концентрацию N02 в воздухе. Однако исследования, проведенные в последние 15-20 лет, показали, что содержание оксида азота NO в приземном слое воздуха сопоставимо с концентрацией NO2. Это является следствием интенсивного поступления NO в атмосферу с поверхности планеты, что делает практически невозможным достижение равновесия. Поэтому при анализе атмосферного воздуха на общее содержание оксидов азота предварительно необходимо окислить NO до NO2 и затем проводить определение содержания NO2 в пробе.
Основные природные источники оксидов азота (процессы денитрификации, окисление NH3, а также окисление азота при разрядах молний) ежегодно поставляют в тропосферу от 21 до 89 млн т NOх в пересчете на элементный азот. Помимо этого в результате антропогенных выбросов еще около 20 млн т азота в виде оксидов выбрасывается в атмосферу. Как природные, так и антропогенные выбросы преимущественно содержат оксид азота NO.
Одним из основных источников образования оксида азота является окисление азота воздуха, сопровождающее все процессы горения, в которых в качестве окислителя используется воздух. С повышением температуры увеличивается равновесное количество оксида азота в воздухе. Процессы сжигания ископаемого топлива на тепловых электростанциях и сжигания топлива в двигателях автомобилей являются основными источниками загрязнения атмосферы оксидами азота.
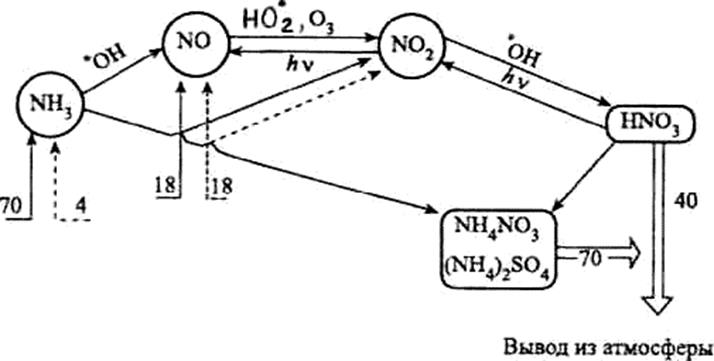
Рис.
Атмосферный цикл соединений азота (числа — млн т элементного азота в год):
® - природные поступления соединений азота;
---® - антропогенные поступления соединений азота;
Þ - вывод из атмосферы
В тропосфере N0, взаимодействуя с гидропероксидным радикалом, переходит в диоксид азота:
N0 + Н02· ® N02 + ·ОН
Другой возможный путь окисления оксида азота — взаимодействие с озоном:
NO + 03 ® N02 + 02
Диоксид азота в тропосфере в присутствии излучения длиной волны l < 398 нм разлагается с образованием оксида азота и атома кислорода:
N02 + hn ® NO + 0(3P)
Образующийся монооксид азота вновь подвергается процессу окисления, а атомарный кислород приводит к появлению в тропосфере озона.
Важной частью атмосферного цикла соединений азота (см. рис.) является образование азотной кислоты. Примерно 44% азотной кислоты в тропосфере образуется в результате взаимодействия диоксида азота с гидроксильным радикалом:
·ОН + N02 + М ® HON02 + М*
Около 24% HNO3 появляется в атмосфере в результате взаимодействия пентаоксида диазота с молекулами Н20 по уравнению (1). До 28% всей выделяющейся в атмосфере азотной кислоты образуется при взаимодействии триоксида азота с органическими кислородсодержащими радикалами.
Часть азотной кислоты разлагается с образованием диоксида или триоксида азота, которые вновь включаются в атмосферный цикл соединений азота (см. рис.):
HN03 + hn (£ 330 нм) ® N02+ ·ОН
HNO3 + ·ОН ® N03 + H20.
В отличие от серной азотная кислота может долгое время оставаться в атмосфере в газообразном состоянии, так как она плохо конденсируется. Пары азотной кислоты поглощаются в атмосфере каплями облаков или частицами аэрозоля.
Основное количество азотной кислоты выводится из тропосферы с атмосферными осадками в виде растворов HN03 и ее солей.
Важную роль в атмосферных процессах с участием соединений азота играет аммиак. В водном растворе аммиак имеет щелочную реакцию, вследствие чего может нейтрализовать атмосферные кислотные соединения:
NH3 + H2SO4 ® NH4HSO4
NH3 + NH4HSO4 ® (NH4)2S04
NH3 + HNO3 ® NH4NO3
Эти химические реакции приводят к образованию сульфата и нитрата аммония.
Важнейшим источником атмосферного аммиака является почва. Находящиеся в почве органические вещества подвержены микробиологической деструкции. Аммиак является одним из продуктов разрушения органических веществ. Особенно большое количество аммиака выделяется в процессе распада мочи домашних животных. Например, в Европе этот источник оказывается даже более значительным, чем выделение аммиака из почвы. Существенным источником служат также производство и внесение в почву азотных удобрений. Поступление аммиака в атмосферу в результате сгорания угля или моторного топлива незначительно.
Ежегодно из природных источников в атмосферу поступает около 70 млн т NH3 в пересчете на азот. Антропогенный вклад в загрязнение атмосферы аммиаком составляет всего около 4 млн т.
В тропосфере аммиачный азот представлен в основном содержащимися в аэрозолях ионами аммония. Общее содержание NH4+-ионов в пересчете на элементный азот составляет примерно 2 млн т, что примерно в два раза превышает общее содержание газообразного аммиака.
С атмосферными осадками и в результате процессов сухого осаждения ежегодно около 70 млн т соединений аммония выводится из атмосферы. Часть аммиака (от 3 до 8 млн т в год) вступает во взаимодействие со свободными радикалами, в основном с гидроксильным радикалом:
NH3 + ·ОН ® ·NH2 + Н20.
В дальнейшем ·NH2 легко окисляется до монооксида азота.
|
из
5.00
|
Обсуждение в статье: Загрязнение атмосферы соединениями азота |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

