 |
Главная |
Условия образования и выпадения осадка
|
из
5.00
|
Осадок малорастворимого электролита образуется тогда, когда после смешивания растворов реагентов произведение молярных концентраций веществ катионов и анионов буде большим, чем ПР осадка при данной температуре (ИП > ПР осадка):
þ [А+]а·[В-]b > ПР(АаВb) – образование осадка (пересыщенный раствор, преобладает процесс осаждения, процесс растворения термодинамически невозможен). При небольшом превышении ПР раствор стает пересыщенным, но осадок некоторое время не выпадает.
þ [А+]а·[В-]b = ПР(АаВb) – осадок не выпадает (насыщенный раствор, динамическое равновесие).
þ [А+]а·[В-]b < ПР(АаВb) – растворение осадка (ненасыщенный раствор).
Осаждение можно считать практически полным, если в растворе остаётся такое количество вещества осаждаемых ионов, которое не мешает в дальнейших операциях разделения и выявления ионов. (ПР ≠ 0, осаждение никогда не бывает полным).
Для более полного осаждения к раствору добавляют избыток реагента-осадителя, но большой избыток осадителя вызывает растворение осадка (солевой эффект).
Влияние электролитов на растворимость осадков:
Ø Растворимость малорастворимого вещества в присутствии других электролитов, имеющих с ним общие ионы, меньше растворимости в чистой воде;
Ø Растворимость малорастворимого осадка в воде увеличивается при добавлении к нему раствора сильного электролита, который не содержит общего иона с осадком (солевой эффект).
Солевой эффект – это повышение растворимости малорастворимых электролитов, находящихся в равновесии с осадком, при добавлении к ним сильных электролитов, которые не содержат одноименных ионов с осадком.
Растворимость малорастворимого электролита в присутствии другого электролита, не содержащего с ним одноименных ионов, увеличивается, что объясняется увеличением ионной силы растворы и уменьшением коэффициента активности каждого из ионов.
Для плохо растворимого электролита: ДР(АаВb) = [А+]а · [В-]b∙ f (А+) ∙f (B-),
где f (А+) и∙f (B-) – коэффициенты активности ионов.
Так как произведение растворимости – величина постоянная, поэтому при увеличении ионной силы раствора концентрация ионов малорастворимого электролита увеличивается, что приводит к увеличению растворимости осадка.
Ø Чем меньше тенденция к переходу осадка в раствор, тем меньше произведение растворимости и растворимость соответствующего соединения;
Ø Направление реакции обмена между двумя электролитами в растворе определяется возможностью образования между ионами малорастворимого соединения, выпадающего в осадок (чем меньшая растворимость образованного малорастворимого соединения, тем сильнее смещено равновесие в сторону её образования).
Наряду с образованием осадка в качественном анализе большое значение имеет и растворение осадка, который является обратным процессу образования:
СаSO4(твердая соль) ↔ Са2+ + SO42-(ионы в растворе)
Сдвиг гетерогенного равновесия вправо может происходить в следующих случаях:
ü происходит связывание ионов в растворе в другой, менее растворимый осадок;
Растворение осадка не происходит, но такая операция позволяет определить в растворе анион или катион, входящий в первоначальный осадок. Соединение, которым проводится обработка, должно быть хорошо растворимо и полностью диссоциировано на ионы.
СdC2O4(ПР = 2,2·10-8) + Рb(NO3)2 ↔ PbC2O4 (ПР = 8,3·10-12) + Сd2+ + 2NO3-;
ü происходит реакция комплексообразования с участием ионов металла;
ü анион переходит в малодиссоциирующую кислоту;
ü происходит восстановление или окисление ионов.
Растворимость осадков зависит от:
a Концентрации ионов водорода (растворимость осадков в кислотах).
Диссоциация малорастворимого соединения:ВаСО3 « Ва2+ + СО32-
При действии на осадок ВаСО3 кислоты (ионов Н+) равновесие между осадком и раствором смещается вправо (согласно принципу Ле Шателье) потому, что карбонат-ион связывается с ионами водорода с образованием слабой угольной кислоты:
2Н+ + СО32- = Н2СО3,
Которая разлагается с выделением СО2; соответственно уменьшается концентрация карбонат-ионов СО32-. Как результат – увеличение растворимости осадка ВаСО3.
Действие кислоты на осадок зависит от:
· Значения произведения растворимости малорастворимой соли(чем больше ПР соли, тем большая растворимость осадка этой соли);
· Величины константы диссоциации образованной слабой кислоты (чем меньше Кдис. слабой кислоты, тем большая растворимость осадка).
a Температуры
Если растворимость вещества в воде сопровождается поглощением теплоты, то повышение температуры вызывает увеличение растворимости осадка (принцип Ле Шателье) – осаждение необходимо проводить на холоде.
Например, растворимость РbCI2 при комнатной температуре равна 10,9г/л, а при 100 С – 333,8г/л.
a Природы растворителя
При добавлении к воде органических растворителей растворимость неорганических солей, как правило, уменьшается: растворимость полярных веществ в полярных растворителях больше, чем в неполярных.
Применение правила произведения растворимости в аналитической химии для:
Ø решения вопросов образования и растворения осадков;
Ø вычисления растворимости малорастворимых соединений (количество молей вещества, содержащихся в 1л насыщенного раствора при данной температуре):
S(АаВb) =  , [S] ‑[моль/л]
, [S] ‑[моль/л]
Ø решения вопросов последовательности образования и выпадения осадков (действие групповых реактивов).
Дробное осаждение – это метод, с помощью которого одним и тем же осадителем последовательно разделяют несколько ионов, пользуясь разными величинами произведения растворимости образованных соединений. В качественном анализе используют в тех случаях, когда осадки отличаются по внешнему виду (окрашивание).
Сущность: сначала выпадает в осадок соединение, произведение растворимости которого имеет меньшую величину.
Гидролиз солей
Гидролиз– это обменное взаимодействие веществ с водой, при которой составные части этого вещества соединяются с составными частями воды. Гидролизу могут подвергаться химические соединения разных классов: соли, жиры, углеводы, белки.
Сущность процесса гидролиза: ионы соли связывают составные части воды (Н+ та ОН-) с образованием малодиссоциированного электролита. Вследствие этого равновесие в реакции диссоциации воды смещается вправо.
 |
| Химическое уравнение гидролиза | Выражение константы гидролиза | ||
| Гидролиз по аниону (анион слабой кислоты): | |||
| СН3СООNa ↔ Na+ + СН3СОО- СН3СОО- + НОН ↔ СН3СООН + ОН- СН3СООNa + Н2О ↔ СН3СООН + NaОН | Кг =  = = 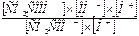 = = = =  ;
рН > 7, среда щелочная. ;
рН > 7, среда щелочная.
| ||
| Гидролиз по катиону (катион слабого основания): | |||
| NH4Cl ↔ NH4+ + Cl- NH4+ + HOH ↔ NH4OH + H+ NH4Cl + H2O ↔ NH4OH + HCl | Кг =  = = = =  ;
рН < 7, среда кислая. ;
рН < 7, среда кислая.
| ||
| Гидролиз по катиону и аниону (катион слабого основания и анион слабой кислоты): | |||
| СН3СООNH4 ↔ СН3СОО- + NH4+ CH3COO- + NH4+ + НОН ↔ СН3СООН + NH4+ОН Реакция среды растворов таких солей определяется соотношением силы образующихся слабых электролитов. Она может приближаться к нейтральной, если константы диссоциации слабого основания и слабой кислоты близки между собой. | Кг =  = =
 К(NH4OH) = 1,76·10-5;
К(СН3СООН) = 1,74·10-5.
рН ≈ 7.
К(NH4OH) = 1,76·10-5;
К(СН3СООН) = 1,74·10-5.
рН ≈ 7.
| ||
| Гидролиз может быть полным и необратимым: АІ2S3 + 6H2O → 2 АІ(ОН)3↓ + 3 Н2S↑ | |

| Этот тип гидролиза усложняет реакции обмена между солями. Малорастворимые соли, образованные остатками очень слабых оснований и кислот, нельзя получить из водных растворов реакциями обмена, так как образуются продукты их полного или частичного гидролиза: |

| |
| 2FeCl3 + 3Na2CO3 + 3H2O → 2Fe(OH)3↓+ 3CO2↑+ 6NaCl | |
| Если рКкисл. = рКосн.(рН=7), реакция среды нейтральная; рКкисл. > рКосн. (рН>7), реакция среды щелочная; рКкисл. < рКосн. (рН<7), реакция среды кислая. |
Значение гидролиза в природе:
ü вследствие гидролиза алюмосиликатов происходит разрушение горных пород;
ü обеспечение слабощелочной реакции среды морской воды.
Значение гидролиза в быту: стирка; мытьё посуды; умывание с мылом; процессы пищеварения.
Использование гидролиза в промышленности:
þ порча производственного оборудования;
þ производство ценных продуктов с непищевого сырья (бумага, мыло, спирт, глюкоза, белковые вещества, дрожжи);
þ очищение промышленных сточных вод и питьевой воды (гидролиз карбоната натрия, фосфата натрия используют для очищения воды и уменьшения её жёсткости);
þ подготовка ткани к покраске;
þ внесение извести в почву.
Использование гидролиза в аналитической химии:
a как характерные реакции открытия катионов Fe3+, Sb3+, Br3+ и анионов СН3СОО-, SіО32-,
a для разделения Cr3+ и Al3+ - ионов;
a для регулирования рН і рОН растворов (добавление NH4+, СН3СОО-).
В практике качественного анализа чаще всего имеют дело с гидролизом солей и солеподобных соединений.
Способы усиления гидролиза:
ü разбавление растворов;
ü повышение температуры;
ü удаление продуктов гидролиза;
ü добавление к раствору: катионов – сильных комплексообразователей и анионов – сильных доноров пар электронов.
Для усиления гидролиза соли, образованной катионом слабого основания и анионом сильной кислоты, необходимо добавить основание для связывания получающихся в процессе гидролиза ионов водорода: NH4+ + HOH ↔ NH4OH + H+
При добавлении основания произойдёт нейтрализация кислоты и динамическое равновесие сдвинется вправо, т.е. гидролиз усилится. Если же к раствору подобной соли прибавить кислоты, то гидролиз затормозится.
Чтобы усилить гидролиз соли, образованной анионом слабой кислоты и катионом сильного основания. Необходимо связать свободные ионы ОН-, получающиеся в процессе гидролиза:
СН3СОО- + НОН ↔ СН3СООН + ОН-.
Прибавление кислоты приводит к нейтрализации основания, и динамическое равновесие сдвигается вправо, т.е. гидролиз усиливается. Если в раствор подобной соли ввести основание, то гидролиз замедлится.
Связать ионы Н+ и ОН- можно в сложные анионы (НСО3-, НРО42-) или в нейтральные молекулы слабых кислот (Н2СО3, СН3СООН, Н3ВО3) добавлением других электролитов.

|
из
5.00
|
Обсуждение в статье: Условия образования и выпадения осадка |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

