 |
Главная |
Кислоты и основания. Влияние положения элемента в периодической системе и степени окисления элемента на состав и кислотно-основные свойства гидроксидов элементов
|
из
5.00
|
Кисло́ты — сложные вещества, которые состоят из атомов водорода, способных замещаться на атомы металлов, и кислотных остатков.
Основания — сложные вещества,которые состоят из атомов металла или иона аммония и гидроксогруппы (-OH).
Основания: По периоду слева направо наблюдается постепенное ослабление основных свойств гидроксидов.
По главным подгруппам сверху вниз сила оснований возрастает.
Если металл образует несколько гидроксидов, находясь в различной степени окисления, то чем выше степень окисления металла, тем более слабыми основными свойствами обладает гидроксид.
Кислоты: По периоду для кислородосодержащих кислот слева направо возрастает сила кислот.
По группе кислородосодержащих кислот сверху вниз уменьшается.
Чем выше степень окисления кислотообразующего элемента, тем сильнее кислота.
Сила бескислородных кислот в главных подгруппах с ростом атомного номера элемента возрастает:


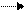 HF HCl HBr HI
HF HCl HBr HI
 СИЛА КИСЛОТ РАСТЕТ
СИЛА КИСЛОТ РАСТЕТ
 По периоду слева направо сила бескислородных кислот возрастает.
По периоду слева направо сила бескислородных кислот возрастает.
Водородные соединения. Зависимость строения и свойств водородных соединений от положения элемента в периодической системе. Особенности строения и химических свойств солеподобных гидридов s- элементов. Строение молекул и химические свойства ковалентных гидридов р- элементов.
p-Элементы с водородом образуют соединения с ковалентно-полярными связями.
Наиболее прочной является водородная связь между молекулами HF,т. к. фтор – наиболее электроотрицательный элемент.
Зависимость: От С до Н уменьшаются валентность и отрицательная степень окисления.
Полярность связи увеличивается к F
C возрастанием порядкового номера прочность КПС уменьшается.
Восстановительные св-ва растут сверху вниз., слева направо увеличиваются
Кислотные справа налево увеличиваются, снизу вверх растут.
Особенности строения:Они характеризуются ионным строением кристаллической решетки и высокими температурами плавления. Все солеобразные гидриды обладают высокой реакционной способностью.
Cтандартный потенциал системы указывает на большую склонность иона H – отдавать электрон, что делает гидриды хорошими восстановителями.
гидридов р- элементов :К ковалентным относят ГИДРИДЫ неметаллов, Al, Be, Sn, Sb. обладают высокой реакционное способностью. Обычно молекулы ковалентных гидридов сравнительно слабо притягиваются друг к другу. Отсутствие сильного межмолекулярного взаимодействия проявляется в высокой летучести и низкой точке плавления. Эти гидриды бывают твердые (обычно полимерные), жидкие и газообразные. Связь между водородом и соответствующим элементом неполярна. Валентные электроны примерно поровну разделены между связанными атомами.
|
из
5.00
|

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

