 |
Главная |
Экзаменационные задания. 1. B 25 № 30. Согласно термохимическому уравнению реакции
|
из
5.00
|
1. B 25 № 30. Согласно термохимическому уравнению реакции

для получения 15 кДж теплоты потребуется оксид кальция массой
1) 3 г
2) 6 г
3) 12 г
4) 56 г
Пояснение.
По уравнению реакции при расходовании 1 моль оксида кальция выделяется 70 кДж теплоты,
тогда при расходовании n моль оксида кальция выделяется 15 кДж теплоты.
составим пропорцию: n/1= 15/70
m(CaO) = M*n
m(CaO) = 56*15/70 = 12 г.
Примечание.
В условии дано грубое значение теплового эффекта реакции, более точная величина — 64,8 кДж.
2. B 25 № 172. Какой объём (н.у.) аммиака может теоретически образоваться при взаимодействии 50 л (н.у.) азота с необходимым объёмом водорода?
1) 100 л
2) 50 л
3) 25 л
4) 75 л
Пояснение.

По уравнению реакции отношения азота и аммиака
1 моль — 2 моль
50 моль — х моль
объемы для газов относятся так же, как их количества вещества, отсюда объем аммиака равен 100 л.
3. B 25 № 2353. Объём (н. у.) оксида углерода(IV), образовавшегося при сжигании 50 л (н. у.) пропана в избытке кислорода, равен
1) 55 л
2) 150 л
3) 200 л
4) 100 л
Пояснение.
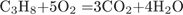 объем углекислого газа будет в 3 раза больше объема исходного пропана, значит он будет равен 150 л.
объем углекислого газа будет в 3 раза больше объема исходного пропана, значит он будет равен 150 л.
4. B 25 № 2439. Объём (н. у.) газа, который образуется при взаимодействии 50 л (н. у.) оксида углерода(II) с избытком кислорода, равен
1) 40 л
2) 50 л
3) 80 л
4) 25 л
Пояснение.
 объем углекислого газа будет равен объему угарного газа.
объем углекислого газа будет равен объему угарного газа.
5. B 25 № 2482. В соответствии с термохимическим уравнением реакции

для получения 160 кДж теплоты используется вода массой
1) 9 г
2) 18 г
3) 27,2 г
4) 44,4 г
Пояснение.
По уравнению реакции при расходовании 1 моль воды выделяется 64,8 кДж теплоты,
тогда нужно чтобы при расходовании n моль воды выделилось 160 кДж теплоты.
составим пропорцию: n/1= 160/64,8
m(воды) = M*n
m(воды) = 18*160/64,8 = 44,4 г.
6. B 25 № 2611. В соответствии с термохимическим уравнением реакции
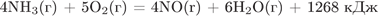
для получения 634 кДж теплоты потребуется аммиак количеством вещества
1) 3 моль
2) 4 моль
3) 2 моль
4) 1 моль
Пояснение.
По уравнению реакции при расходовании 4 моль аммиака выделяется 1268 кДж теплоты,
тогда нужно чтобы при расходовании n моль выделилось 634 кДж теплоты.
составим пропорцию: n/4= 634/1268
n=2
7. B 25 № 2654. Какой объём (н. у.) оксида углерода(II) можно окислить 27 л (н. у.) кислорода?
1) 13,5 л
2) 54 л
3) 50 л
4) 27 л
Пояснение.
 объем угарного газа будет в 2 раза больше объема кислорода, значит 54 л.
объем угарного газа будет в 2 раза больше объема кислорода, значит 54 л.
8. B 25 № 2697. Объём (н. у.) оксида углерода(IV), который образуется при окислении 2 л (н. у.) оксида углерода(II) кислородом воздуха, равен
1) 1 л
2) 2 л
3) 3 л
4) 4 л
Пояснение.
 объем углекислого газа равен объему угарного газа.
объем углекислого газа равен объему угарного газа.
9. B 25 № 3084. Какой объём (н. у.) водорода образуется при полном разложении 110 л (н. у.) метана до простых веществ?
1) 220 л
2) 22 л
3) 110 л
4) 440 л
Пояснение.
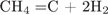 объем водорода в 2 раза больше объема исходного метана, значит он равен 220 л.
объем водорода в 2 раза больше объема исходного метана, значит он равен 220 л.
10. B 25 № 3298. Какой объём (н.у.) аммиака может теоретически образоваться при взаимодействии 50 л (н.у.) азота с необходимым объёмом водорода?
1) 100 л
2) 50 л
3) 25 л
4) 75 л
Пояснение.

объем аммиака будет в два раза больше объема азота, значит он равен 100 л.
11. B 25 № 4115. В результате реакции, термохимическое уравнение которой  выделилось 1479 кДж теплоты. Масса образовавшейся при этом воды равна
выделилось 1479 кДж теплоты. Масса образовавшейся при этом воды равна
1) 100 г
2) 110 г
3) 120 г
4) 130 г
Пояснение.
Составим пропорцию:
при образовании 36 г воды выделяется 484 кДж тепла
при образовании х г воды выделяется 1479 кДж тепла
Откуда  (г)
(г)
Правильный ответ указан под номером: 2
|
из
5.00
|
Обсуждение в статье: Экзаменационные задания. 1. B 25 № 30. Согласно термохимическому уравнению реакции |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

