 |
Главная |
Экзаменационные задания. 1. B 26 № 40. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.)
|
из
5.00
|
1. B 26 № 40. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2, равна
1) 140 г
2) 144 г
3) 148 г
4) 152 г
Пояснение.
Необходимо составить уравнение реакции 2Н2S + 3O2 = 2SO2 + 2H2O. Рассчитать количество вещества сероводорода 67,2/22,4=3 моль. Можно соотнести любым методом количества вещества по уравнению и по условию задачи между сероводородом и кислородом. Получится что количество вещества кислорода получится тоже 4,5 моль, т.к. между ними соотношение по уравнению реакции 2 к 3. Рассчитать массу кислорода m= M* n (количество вещества). M= 32 г/моль (по таблице Менделеева) Следовательно m= 32 г/моль * 4,5 моль = 144 г
2. B 26 № 182. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) сероводорода до SO2 равна __________ г. (Запишите число с точностью до целых.)
1) 121
2) 122
3) 144
4) 141
Пояснение.
Необходимо составить уравнение реакции  . Рассчитать количество вещества сероводорода 67,2 / 22,4 = 3 моль. Можно соотнести любым методом количества вещества по уравнению и по условию задачи между сероводородом и кислородом. Получится, что необходимое количество вещества кислорода равно 4,5 моль, т. к. между ними соотношение по уравнению реакции 2 к 3. Рассчитать массу кислорода m = M * n (количество вещества). M = 32 г / моль (по таблице Менделеева). Следовательно m = 32 г / моль * 4,5 моль = 144 г.
. Рассчитать количество вещества сероводорода 67,2 / 22,4 = 3 моль. Можно соотнести любым методом количества вещества по уравнению и по условию задачи между сероводородом и кислородом. Получится, что необходимое количество вещества кислорода равно 4,5 моль, т. к. между ними соотношение по уравнению реакции 2 к 3. Рассчитать массу кислорода m = M * n (количество вещества). M = 32 г / моль (по таблице Менделеева). Следовательно m = 32 г / моль * 4,5 моль = 144 г.
3. B 26 № 2363. При растворении сульфида железа(II) в избытке разбавленной серной кислоты выделилось 11,2 л (н. у.) газа. Масса сульфида железа(II) равна __________ г. (Запишите число с точностью до целых.)
1) 12
2) 32
3) 21
4) 44
Пояснение.

n(  ) = V/V_m = 11,2/22,4=0,5 моль
) = V/V_m = 11,2/22,4=0,5 моль
количество моль сульфида железа(II) = количеству моль сероводорода, значит
m=M(сульфида железа(II))*n(  )= 88*0,5 = 44 г
)= 88*0,5 = 44 г
4. B 26 № 2449. Какой объём (н. у.) водорода выделится при взаимодействии 0,4 моль калия с избытком воды? (Запишите число с точностью до сотых.)
1) 1,12
2) 2,24
3) 4,48
4) 8,96
Пояснение.

n(  ) = 0,5*n(калия) =0,2 моль
) = 0,5*n(калия) =0,2 моль
V(водорода)=n*V_m = 0,2*22,4 = 4,48 л
5. B 26 № 2492. При сливании раствора нитрата серебра с избытком раствора хлорида натрия образовался осадок массой 28,6 г. Масса нитрата серебра в исходном растворе равна ___________ г. (Запишите число с точностью до целых.)
1) 43
2) 12
3) 23
4) 34
Пояснение.

n(хлорида серебра) = m/M = 28,6/143,5 = 0,2 моль
количество моль нитрата серебра = количеству моль хлорида серебра, значит
m(нитрата серебра)=M(нитрата серебра)*n(хлорида серебра)= 170*0,2 = 34 г
6. B 26 № 2621. При взаимодействии лития с водой образовался гидроксид лития количеством вещества 0,25 моль. Какой объём (н. у.) водорода при этом выделился? (Запишите число с точностью до десятых.)
1) 1,3 л
2) 2,3 л
3) 2,5л
4) 2,8 л
Пояснение.

n(  ) = 0,5*n(лития) =0,125 моль
) = 0,5*n(лития) =0,125 моль
V(водорода)=n*V_m = 0,125*22,4 = 2,8 л
7. B 26 № 2664. Через раствор, содержащий 29,4 г серной кислоты, пропустили аммиак до образования средней соли. Объём (н. у.) прореагировавшего газа составил (с точностью до сотых)
1) 13,44 л
2) 13,66 л
3) 12,44 л
4) 11,66 л
Пояснение.

n(серной кислоты) = m/M = 29,4/98 = 0,3 моль
количество моль аммиака = двухкратному количеству моль серной кислоты, значит
V(аммиака)= 2*n(серной кислоты)*V_m= 13,44 л
8. B 26 № 2707. Через раствор, содержащий серную кислоту, пропустили 6,72 л (н. у.) аммиака до образования средней соли. Масса образовавшейся при этом соли равна_г. (Запишите число с точностью до десятых.)
1) 20,1
2) 19,8
3) 10,5
4) 13,1
Пояснение.

n(аммиака) = V/V_m = 6,72/22,4 = 0,3 моль
количество моль сульфата аммония = половине количества моль аммиака, значит
m(сульфата аммония)= 0,5*n(аммиака)*M= 19,8 г
9. B 26 № 2750. Масса осадка, образовавшегося при смешивании раствора, содержащего 34 г нитрата серебра, и избытка раствора хлорида натрия, равна ____________ г. (Запишите число с точностью до десятых.)
1) 13,5
2) 28,7
3) 13,3
4) 14,6
Пояснение.

n(нитрата серебра) = m/M = 34/170 = 0,2 моль
количество моль нитрата серебра = количеству моль хлорида серебра, значит
m(хлорида серебра)=M(хлорида серебра)*n(нитрата серебра)= 28,7 г
10. B 26 № 2836. При взаимодействии лития с водой образовался гидроксид лития количеством вещества 0,25 моль. Какой объём (н. у.) водорода при этом выделился?
1) 0,125 л
2) 0,5 л
3) 2,24л
4) 2,8 л
Пояснение.
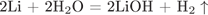
Количество моль водорода в два раза меньше гидроксида лития, значит 0,125 моль. Объем равен 0,125*22,4 = 2,8 литра
11. B 26 № 2922. Масса оксида железа, образующегося при нагревании 53,5 г гидроксида железа(III), равна
1) 20 г
2) 30 г
3) 40 г
4) 50 г
Пояснение.

n(гидроксида железа(III)) = m/M = 53,5/107 = 0,5 моль
количество моль оксида железа(III) = половине количества моль гидроксида железа(III), значит
m(оксида)=M(оксида)*n(гидроксида)/2= 160*0,25 = 40 г
12. B 26 № 3094. Гидроксид железа(III) массой 53,5 г обработали раствором серной кислоты. Масса образовавшейся при этом средней соли равна ___________г. (Запишите число с точностью до целых.)
1) 200
2) 100
3) 50
4) 150
Пояснение.

n(гидроксида) = m/M = 53,5/107 =0,5 моль
количество моль сульфата железа(III) = половине количества моль гидроксида железа(III), значит
m(соли)=M(сульфата железа(III))*n(гидроксида)*0,5= 100 г
13. B 26 № 3266. Карбид алюминия массой 8,64 г растворили в избытке соляной кислоты. Объём (н. у.) газа, выделившегося при этом, (с точностью до целых) составил
1) 1 л
2) 2 л
3) 3 л
4) 4 л
Пояснение.

n(карбида алюминия) = m/M = 8,64/144 = 0,06 моль
n(метана) = 3*n(карбида алюминия) =0,18 моль
V(метана)=n*V_m = 0,18*22,4 = 4,032 л
Ответ: 4 л
14. B 26 № 3299. Масса кислорода, необходимого для полного сжигания 6,72 л(н.у.) сероводорода, равна
1) 0,3 г
2) 0,45 г
3) 10,8 г
4) 14,4 г
Пояснение.

n(сероводорода)=6,72/22,4 = 0,3 моль
n(кислорода)=1,5n(сероводорода)=0,45 моль
m(кислорода)=0,45*32=14,4 г.
|
из
5.00
|
Обсуждение в статье: Экзаменационные задания. 1. B 26 № 40. Масса кислорода, необходимого для полного сжигания 67,2 л (н.у.) |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

