 |
Главная |
Лабораторная работа №1
|
из
5.00
|
ЗАНЯТИЕ №1
Тепловые эффекты химических процессов. Закон Гесса и его следствия. Теплоемкость. Уравнение Кирхгофа.
Лабораторная работа №1
«Определение константы калориметра по известному тепловому эффекту процесса»
Экспериментальное определение тепловых эффектов проводят в специальных приборах – калориметрах, имеющих различные конструкции. Калориметры бывают изотермические и адиабатические. Устройство калориметра и сложность калориметрической установки зависят от вида химической реакции, тепловой эффект которой определяют, а также от желаемой точности получаемых результатов. В более простых случаях, когда исходные и конечные продукты реакции жидкие или растворы и объем системы изменяется мало, калориметр может быть построен из двух вставленных один в другой стаканов. В особенно сложных случаях, когда в процессе реакции из твердых веществ или жидкостей образуются газы, реагирующие вещества помещают в герметические калориметрические бомбы, способные выдерживать большие давления. Это позволяет вести реакции при постоянном объеме и получать QV=DU, т.к. работа расширения при этом равна 0.
Простейший калориметр состоит из изотермической оболочки с крышкой, в которую помещают калориметрический стакан. В зависимости от целей работы стакан заполняют различной калориметрической жидкостью: водой, раствором щелочи и т. д. В жидкость опускают мешалку и термометр для измерения температуры в ходе калориметрического опыта. На крышке изотермической оболочки имеется отверстие для ввода в калориметр исследуемого вещества. Уравнение теплового баланса калориметрического опыта можно записать в виде:
 ,
,
где DH – тепловой эффект процесса, протекающего в калориметре;
Dt - изменение температуры в опыте;
К - постоянная калориметра.
Постоянная калориметра равна количеству теплоты, необходимому для нагревания всех частей калориметра на 10 С:
Если Dt = 1°C, то К = DН
Величину постоянной калориметра приближенно можно рассчитать как сумму теплоемкостей всех частей калориметра, участвующих в теплообмене.

mi – масса отдельных частей калориметра, участвующих в теплообмене;
ci - их удельные теплоемкости.
Постоянную калориметра можно определить, если измерить в калориметрическом опыте изменение температуры Dt при растворении в заданном объеме растворителя соли массой m с известной интегральной теплотой растворения DHраств.
Тепловой эффект калориметрического опыта при растворении соли будет равен:
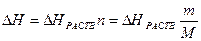 , где
, где
m – масса соли, г
М – молярная масса соли, г/моль.
Постоянную калориметра рассчитывают по формуле:

ХОД ВЫПОЛНЕНИЯ РАБОТЫ
| ВИД ДЕЙСТВИЯ | СПОСОБ ДЕЙСТВИЯ |
| 1. Собрать калориметр | 1. В стакан емкостью 0,5 л налить 400 мл дистиллированной воды. Закрыть калориметр крышкой, чтобы получилась закрытая калориметрическая система. |
| 2. Провести «предварительный период» калориметрического опыта. | 1. Медленно размешивая мешалкой воду, записывать в течение 5 мин показания термометра через каждые 30-60 с. |
| 3. Провести «главный» и «заключительный периоды» калориметрического опыта, растворив навеску хлорида калия в воде. | 1. На 5-й минуте, не отключая мешалку и секундомер, открыть пробку на крышке калориметра и быстро всыпать навеску хлорида калия массой 11,4 г. Продолжать записывать температуру через каждую минуту до тех пор пока вся соль не раствориться и температура раствора не станет почти постоянной. После этого продолжать запись показаний термометра еще в течение 5 минут. |
4. Определить изменение температуры Dt калориметрического опыта.
 Рис. Кривая калориметрического опыта при экзотермическом процессе.
Рис. Кривая калориметрического опыта при экзотермическом процессе.
| 1. Данные наблюдения записать в таблицу. 2. На основании полученных данных построить на миллиметровой бумаге график (аналогичный, представленному на рисунке), отложив по оси абсцисс время (t, мин) в масштабе 1 мин=0,5 –1 см, а по оси ординат – температуру (t, °С). Выбор масштаба по оси ординат зависит от величины Dt. При Dt меньше одного градуса выбирают масштаб 10С = 10 см, а при Dt больше одного градуса – 10С = 5 -10 см. График, отражающий зависимость t0 C = f (t) должен иметь вид: 1 – начальный период 2 - главный период 3 – заключительный период отрезок EF = Dt. |
| 5. Вычислить постоянную калориметра. | 1. Вычисления провести по формуле:
 ,
где ,
где  Табличные данные:
DHРАСТВ(KCl) = … кал/моль (см. справочник Никольского)
M(KCl) = 74,5 г/моль
Табличные данные:
DHРАСТВ(KCl) = … кал/моль (см. справочник Никольского)
M(KCl) = 74,5 г/моль
|
Приложение
|
из
5.00
|
Обсуждение в статье: Лабораторная работа №1 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

