 |
Главная |
Глава 5. Свойства соединений фосфора: фосфин и фосфиды, фосфиновая кислота и фосфиты, фосфоновая кислота и фосфонаты
|
из
5.00
|
Фосфин
Водородное соединение фосфора – фосфин РН3. Строение молекулы фосфина похоже на строение молекулы аммиака, хотя из-за меньшего вклада s-орбитали в гибридизацию валентный угол практически равен 90°, неподеленная электронная пара занимает преимущественно s-орбиталь, она становится менее доступной для образования связей по донорно-акцепторному механизму, поэтому фосфин гораздо хуже растворим в воде и проявляет меньшую основность, чем аммиак.
Фосфин – бесцветный газ с запахом гнилой рыбы. Очень ядовит, на воздухе воспламеняется, может образовывать взрывчатые смеси. Температура плавления -134 °С, температура кипения -88 °С, то есть значительно ниже, чем у аммиака. Растворимость в воде также значительно меньше, при 17 °С в 100 мл воды растворяется всего 26 мл фосфина. Эти свойства связаны со строением молекулы РН3.
Химические свойства
Фосфин сильно отличается от его аналога аммиака. Его химическая активность выше, чем у аммиака, он плохо растворим в воде, как основание значительно слабее аммиака. Последнее объясняется тем, что связи H-P поляризованы слабо и активность неподелённой пары электронов у фосфора (3s2) ниже, чем у азота (2s2) в аммиаке.
В отсутствие кислорода при нагревании разлагается на элементы:

на воздухе самопроизвольно воспламеняется (в присутствии паров дифосфина или при температуре свыше 100 °C):
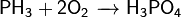
Проявляет сильные восстановительные свойства:


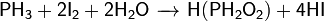
При взаимодействии с сильными донорами протонов фосфин может давать соли фосфония, содержащие ион PH4+ (аналогично аммонию). Соли фосфония, бесцветные кристаллические вещества, крайне неустойчивы, легко гидролизуется.


Соли фосфина, как и сам фосфин, являются сильными восстановителями.
Фосфиды
Фосфи́ды - бинарные соединения фосфора с другими менее электроотрицательными химическими элементами, в которых фосфор проявляет отрицательную степень окисления.
По типу химической связи фосфиды подразделяют на соединения с преимущественно ионной связью, металлоподобные и с преимущественно ковалентной связью. К ионным относятся фосфиды щелочных и щелочноземельных элементов и металлов подгруппы цинка. Эти фосфиды легко гидролизуются водой, хорошо растворяются в клетках с выделением PH3, сгорают в токе O2 с образованием оксидов металлов и P, реагируют с галогенами. Некоторые из них обладают полупроводниковыми свойствами из-за того, что в межатомной связи присутствует определенная доля ковалентной составляющей.Их состав, как правило, не соответствует валентностям образующих их элементов. Эти фосфиды тугоплавки, устойчивы к действию воды и кислот. Их химическая стойкость растет с увеличением содержания P. Так, Ni3P, Cr3P, Fe3P, Ti3P легко разлагаются кислотами-окислителями (H2SO4, HNO3, HClO4), а также щелочами. В то же время фосфиды состава TiP, VP, TaP, CrP, FeP, MnP не взаимодействуют с концентрированной соляной кислотой и кислотами-окислителями. Они растворяются при нагревании в царской водке. Все металлоподобные фосфиды разлагаются смесью HF и HNO3 и при сплавлении с щелочами и пероксидами металлов. Многие из них полупроводники благодаря тому, что в химическая связь вносит определенный вклад ковалентная составляющая.
Ковалентные фосфиды образуются непереходными элементами III и IV гр. периодической системы (кроме Tl). Они тугоплавки, их хим. стойкость к воде и другим агрессивным средам сильно зависит от чистоты образца. Особенно устойчивы высоко чистые вещества. Все твердые ковалентные фосфиды-полупроводники, ширина запрещенной зоны которых тем больше, чем выше доля ионной связи в них. Типичные полупроводниковые фосфиды этой группы представляют собой координационные соединения, в которых помимо простых ковалентных связей присутствуют донорно-акцепторные связи. При этом атом P - донор, а атомы более электроположительного элемента - акцепторы электронной пары.
Фосфиды полуметаллов и неметаллов также главным образом ковалентные соединения Они могут быть газами (напр., PH3), твердыми веществами; по электрофизическим свойствам -диэлектриками или полупроводниками. Типичный диэлектрик - BP. Он устойчив к действию кислот-окислителей и щелочей. Другие фосфиды этой группы, напр. AlP и SiP, не обладают большой стойкостью к действию хим. реагентов.
Фосфоновые кислоты
Фосфоновые кислоты- соединения общей формулы RP(O)(OH)2, где R - орг. радикал, связанный с атомом P связью C-P.
Фосфоновые кислоты, как правило, гигроскопичные бесцветные кристаллы с четкими температурами плавления; растворимы в воде и полярных органических растворителях. Фосфоновые кислоты - двухосновные кислоты средней силы; склонны к димеризации. Для многих из них значения рK1 находятся в области 1,1-2,8, рК2 3,9-8,5.
С основаниями фосфоновые кислоты образуют кислые и средние соли (эфиры и соли фосфоновых кислот наз. фосфонатами). Фосфоновые кислоты, содержащие пергалогеналкильные и некоторые замещенные ароматичными радикалы, реагируют с избытком щелочи с разрывом связи P-C. При длительном нагревании фосфоновые кислоты отщепляют H2O и образуют олигоконденсированные соединения.
Фосфоновые кислоты этерифицируются только в присутствии катализаторов (напр., карбодиимидов). Моно- или диэфиры образуются при действии на фосфоновые кислоты диазоалканов, эпоксидов, азиридинов. При действии PCl5, SOCl2 или SF4 образуются соответствующие дигалогенангидриды. Нагревание фосфоновых кислот с их дихлорангидридами приводит к ангидридам фосфоновых кислот.
Обычно фосфоновые кислоты получают гидролизом RP(O)X2 (X = Cl, Br, OR, SR, NR2; X2 = О), окислением первичных фосфинов или фосфонистых кислот, при взаимодействии фосфористой кислоты с олефинами или карбонильными соединениями, а также в реакциях PCl3 с нитрилами, карбоновыми кислотами, альдегидами и кетонами, например:

Аналоги фосфоновых кислот, содержащие атомы S или Se- обычно малоподвижные жидкости, склонные к разложению при повышенных темпепатурах и в водных растворах; они обладают несколько более высокой кислотностью, чем их кислородные аналоги. Многие их свойства и способы получения такие же, как описаны выше. Специфичный способ синтеза ди- и тритиофосфоновых кислот - взаимодействие P4S10 с реактивом Гриньяра с последу.щим гидролизом гидролизом:

Фосфиты
Фосфиты, соли и эфиры фосфористой кислоты H3PO3. Соли бывают однозамещённые (например, NaH2PO3×2,5H2O) и двухзамещённые (например, Na2HPO3×5H2O). Большинство из них, кроме фосфитов щелочных металлов, труднорастворимы в воде. При прокаливании фосфиты распадаются на соответствующие фосфаты и производные фосфора низших степеней окисления вплоть до фосфина PH3. Фосфиты в водных растворах окисляются галогенами, солями ртути (например, HgCl2) до фосфатов. Образуются при нейтрализации фосфористой кислоты гидроокисями. Применяют как восстановители в неорганических синтезах. Фосфиты свинца – светостабилизатор в производстве поливинилхлорида.
Эфиры фосфористой кислоты бывают одно-, двух- и трёхзамещённые, соответственно ROP (O) HOH, (RO)2P (O) H, (KO)3P. Получаются при взаимодействии трёххлористого фосфора со спиртами или алкоголятами:
PCl3 + 3ROH ® (RO)2P (O)
HPCl3 + 3RONa ® (RO)3P
Используются как стабилизаторы полимерных материалов и масел и как полупродукты синтеза фосфорорганических соединений.
Фосфонаты
Фосфонаты - сложные эфиры фосфоновых кислот общей формулы RP(O)(OR1)n(OH)2-n. В зависимости от числа гидроксильных групп фосфонаты делятся на первичные (n=1, кислые фосфонаты), и вторичные (n = 2, полные фосфонаты).
Фосфонаты с низшими алкильными, алкенильными и арильными заместителями -бесцветные жидкости, фосфонаты с высокими молекулярными массами - масла или кристаллы. Связи при атоме фосфора имеют тетраэдрическую конфигурацию, в ИК-спектрах присутствует характеристическая полоса связи P=O при 1200-1280 см−1.
Первичные фосфонаты являются умеренно сильными кислотами (например, для n-ClC6H4P(O)(OC4H9)OH рКа = 1,7) и образуют соли аминами, вторичные образуют аддукты с кислотами Льюиса (например, с галогенидами бора).
Первичные фосфонаты при нагревании диспропорционируют с образованием полифосфатов, вторичные диалкилфосфонаты при нагревании выше 150°С разлагаются с образованием первичных фосфонатов и алкенов:
RP(O)(CH2CH2R1)2  RP(O)(OH)CH2CH2R1 + R1CH=CH2
RP(O)(OH)CH2CH2R1 + R1CH=CH2
При взаимодействии с пятихлористым фосфором и первичные, и вторичные фосфонаты образуют хлорангидриды фосфоновых кислот: RP(O)R12 + PCl5  RP(O)R1Cl + R1Cl + POCl3
RP(O)R1Cl + R1Cl + POCl3
Глава 6. Качественные реакции на ионы NН4+ (со щелочами), NО2– ( в кислой среде), NО3– (с медью и серной кислотой), РО43– (с нитратом серебра).
Качественная реакция на ионы NH4+
1) При действии щелочей при нагревании выделяется аммиак, который обнаруживают по характерному запаху, по посинению влажной лакмусовой бумаги или по почернению фильтровальной бумаги, смоченной раствором соли ртути (I). Чувствительность реакции - 0,05 µг; предельное разбавление 1:106.
NH4Cl + NaOH = NaCl + NH3 + H2O
(NH4+ + OH- = NH3 + H2O)
Качественная реакция на NО3– (с медью и серной кислотой)
NО2– (с перманганатом калия в кислой среде)Нитраты реагируют с медью в присутствии концентрированной серной кислоты с выделением диоксида азота ( бурого газа) и образование зеленовато-синего раствора ( при добавлении воды раствор становится голубым)
Cu + 2NO3- + 4H+= Cu2+ 2NO2 + 2H2O
Качественная реакция NО2– в кислой среде
Кислоты взаимодействуют с нитрит-ионами с образованием азотистой кислоты, которая разлагается с выделением газа , буреющего на воздухе ( NO окисляется до NO2)
3NO2- + 2H+= NO3- + 2NO2+Н2O
2NO + O2= 2NO2
Качественная реакция на РО43– (с нитратом серебра).
Образование с солями серебра желтого осадка, легко растворимого в серной кислоте или растворе аммиака
3AgNO3 + H3PO4= Ag3PO4 + 3HNO3
|
из
5.00
|
Обсуждение в статье: Глава 5. Свойства соединений фосфора: фосфин и фосфиды, фосфиновая кислота и фосфиты, фосфоновая кислота и фосфонаты |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

