 |
Главная |
ЛИОФИЛЬНЫЕ И ЛИОФОБНЫЕ ЗОЛИ
|
из
5.00
|
Министерство образования и науки Российской Федерации
Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования
«МАТИ - Российский государственный технологический
университет имени К. Э. Циолковского»
Кафедра «Моделирование систем и информационные технологии»
МЕТОДЫ ПОЛУЧЕНИЯ ЗОЛЕЙ
Методические указания к лабораторным работам
по дисциплине «ХИМИЯ»
Составители:
Белова С. Б.
Гришина Н. Д.
Белов С. П.
МОСКВА 2011
Методы получения золей :Методические указания к лабораторным работам по дисциплине «Химия» / сост. С. Б. Белова, Н. Д. Гришина, С. П. Белов ─ М.: МАТИ, 2011 ─ 24 с.
© Белова С. Б.,
Гришина Н. Д.
Белов С. П.
составление, 2011
© МАТИ, 2011
| |
Введение
Коллоидные системы (системы, размер частиц дисперсной фазы в которых составляет 10-7 – 10-9 м) подразделяются на две группы, резко отличные по характеру взаимодействий между частицами дисперсной фазы и дисперсионной среды: 1 — лиофобные коллоидные растворы (золи), 2 — лиофильные коллоиды (современное название— растворы высокомолекулярных соединений (ВМС).
К лиофобным коллоидам относятся системы, в которых частицы дисперсной фазы слабо взаимодействуют с дисперсионной средой; эти системы могут быть получены только с затратой энергии и устойчивы лишь в присутствии стабилизаторов.
Растворы ВМС образуются самопроизвольно благодаря сильному взаимодействию частиц дисперсной фазы с дисперсионной средой и способны сохранять устойчивость без стабилизаторов. Лиофобные коллоиды и растворы ВМС различаются также и структурой частиц, составляющих дисперсную фазу. Для лиофобных коллоидов единицей структуры является сложный многокомпонентный агрегат переменного состава – мицелла, для растворов ВМС – макромолекула.
Данные методические указания направлены на ознакомление с некоторыми методами получения коллоидных растворов.
ЛИОФИЛЬНЫЕ И ЛИОФОБНЫЕ ЗОЛИ
Лиофильные золи образуются самопроизвольно и не разрушаются со временем. Лиофобные золи постепенно разрушаются вследствие самопроизвольного слипания твердых частиц (коагуляция) или слияния жидких частиц (коалесценция), хотя при наличии стабилизатора эти процессы могут быть очень длительными.
Рассмотрим образование золя и строение его частиц на примере хлорида серебра AgCl. Этот золь образуется при медленном приливании водного раствора хлорида натрия NaCl к водному раствору нитрата серебра AgNO3, взятому в избытке (если ввести сразу большую порцию раствора NaCl, то мгновенно выпадет осадок хлорида серебра и золь не получится). Реакция протекает по уравнению:
Ag+ + Cl– = AgCl.
При постепенном приливании раствора NaCl в раствор AgNO3 в первый момент из ионов Ag+ и Cl– образуется агрегат (AgCl)n, в котором ионы расположены в том же порядке, что и в кристаллической решетке AgCl.
Далее агрегат (AgCl)n адсорбирует на своей поверхности преимущественно те ионы, которые входят в его состав (или изоморфны по типу кристаллической решетки) и находятся в растворе в избытке. Этим условиям в данном случае отвечают ионы серебра. В результате адсорбации ионов Ag+ агрегат из хлорида серебра со слоем ионов серебра приобретает положительный заряд.
Ионы, адсорбирующиеся на поверхности агрегата, придают частице заряд и называются потенциалопределяющими. Наличие одноименных зарядов на агрегатах препятствует их объединению и росту кристалла AgCl. Таким образом агрегаты AgCl с адсорбированными на них ионами приобретают состояние агрегативной устойчивости.
Агрегат (AgCl)n вместе с потенциалопределяющими ионами Ag+ составляет ядро. К заряженному ядру притягиваются ионы противоположного заряда – противоионы. В данном случае такими ионами будут ионы, содержащиеся в растворе (но не входящие в состав агрегата), – нитрат-ионы NO3–. Противоионы, непосредственно примыкающие к ядру, образуют адсорбционный слой противоионов.
За адсорбционным слоем противоионов следует диффузный слой тех же противоионов. Количество противоионов диффузного слоя постепенно понижается по мере удаления от ядра. Противоионы диффузного слоя ориентируют вокруг себя полярные молекулы растворителя, создавая дополнительную сольватную (гидратную) оболочку.
Ионы адсорбционного слоя сравнительно прочно связаны с агрегатом, а противоионы диффузного слоя находятся под действием двух факторов: электростатического притяжения ионами противоположного заряда, которое удерживает их вблизи ядра, и броуновского движения, стремящегося распределить их в дисперсионной среде.
Ядро вместе с противоионами адсорбционного слоя составляет коллоидную частицу, или гранулу. Гранула с противоионами диффузного слоя называетсямицеллой. Следует иметь в виду, что знак заряда гранулы соответствует знаку заряда потенциалопределяющих ионов. Мицелла в отличие от гранулы электронейтральна.
Формулу мицеллы гидрозоля хлорида серебра записывают так:
{n(AgCl), mAg+, (m – x)NO3–}x+xNO3–.
В фигурные скобки заключена гранула. Ионы, указанные за фигурными скобками, составляют внешнюю часть мицеллы. Строение мицеллы хлорида серебра представлено на рис. 1. Подобный механизм мицеллобразования относится к лиофобным коллоидам.
Строение мицеллы и заряд гранулы зависят от способа получения коллоидного раствора. Если медленно приливать разбавленный раствор нитрата серебра к раствору хлорида натрия, взятому в избытке, то на поверхности агрегата n(AgCl) будут адсорбироваться хлорид-ионы, имеющиеся в растворе в избытке (образуется слой потенциалопределяющих ионов), а в качестве противоионов адсорбционного и диффузионного слоев будут выступать ионы натрия.

| Рис. 1. Строение (разрез) мицеллы хлорида серебра |
Состав мицеллы полученного гидрозоля записывается формулой:
{n(AgCl), mCl–, (m – x)Na+}x–xNa+.
Основу мицеллы составляет нерастворимое в данной среде ядро, микрокристалл или совокупность микрокристаллов.
Рассмотрим другие примеры образования дисперсной фазы. Прильем к раствору хлорида железа FеCl3 по каплям раствор гидроксида натрия NaОН до помутнения раствора или образования хлопьев малорастворимого гидроксида железа Fe(ОН)3:
Fe3+ + 3OH– = Fe(ОН)3.
Образовавшаяся мицелла имеет такое строение:
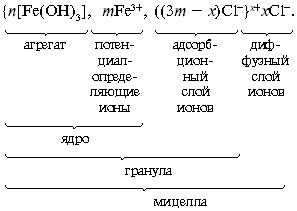
В слой потенциалопределяющих ионов могут входить не только ионы Fe3+, но и образующиеся при гидролизе ионы Fe(OH)2+, Fe(OH)2+ и др. Примерно таково же строение мицеллы гидроксида алюминия.
При медленном приливании раствора хлорида железа в раствор гидроксида натрия процесс образования мицеллы протекает намного сложнее, но теоретически можно предположить, что гидроксид-ионы могут быть потенциалопределяющими, а ионы натрия входят в состав адсорбционного и диффузного слоев.
Состав мицеллы кремниевой кислоты, образующейся при приливании к раствору силиката натрия (избыток) сильной кислоты, может быть выражен такой формулой:
{[nH2SiO3], mHSiO3–, (m – x)Na+}х–xNa+.
Изучение заряда гранулы имеет большое значение для объяснения и предсказания поведения дисперсных систем. Слой ионов вокруг агрегата и противоинов адсорбционного и диффузного слоев представляет собой двойной электрический слой. Число положительных и отрицательных зарядов в нем одинаково, поэтому мицелла электронейтральна.
Между ядром и раствором возникает полный электрический потенциал или термодинамический 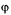 (фи)-потенциал. Это – разность потенциалов, созданных всеми положительными и отрицательными зарядами мицеллы. Другой потенциал, называемый электрокинетическим, или
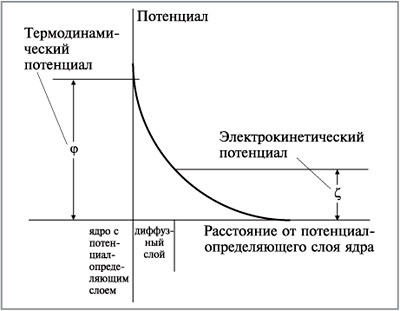
(фи)-потенциал. Это – разность потенциалов, созданных всеми положительными и отрицательными зарядами мицеллы. Другой потенциал, называемый электрокинетическим, или  (дзета)-потенциалом, существует между слоем ионов адсорбционного слоя и диффузного слоя. Электрокинетический потенциал назван так потому, что диффузный слой подвижен и может смещаться при движении мицеллы. Этот потенциал составляет часть термодинамического потенциала и всегда меньше его (рис. 2).
(дзета)-потенциалом, существует между слоем ионов адсорбционного слоя и диффузного слоя. Электрокинетический потенциал назван так потому, что диффузный слой подвижен и может смещаться при движении мицеллы. Этот потенциал составляет часть термодинамического потенциала и всегда меньше его (рис. 2).
|
Рис. 2. Сопоставление термодинамического ( 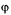 ) и электрокинетического ( ) и электрокинетического (  ) потенциалов ) потенциалов
|
Добавление ионов, особенно многозарядных, может привести к их адсорбции в таких количествах, что произойдет перезарядка гранулы и изменение знака электрокинетического потенциала. Когда все противоионы находятся в адсорбционном слое,  -потенциал становится равным нулю. Подобное состояние называется изоэлектрическим состоянием (изоэлектрической точкой).
-потенциал становится равным нулю. Подобное состояние называется изоэлектрическим состоянием (изоэлектрической точкой).
С увеличением концентрации ионов электрокинетический потенциал уменьшается, проходит через изоэлектрическую точку, изменяет знак и снова увеличивается. В изоэлектрическом состоянии электрокинетический потенциал равен нулю, и в этом состоянии дисперсные системы наименее устойчивы, частицы укрупняются, выпадают в осадок, и из ядра, играющего роль кристаллического зародыша, вырастает кристалл. Лиофильные системы в отличие от лиофобных в изоэлектрическом состоянии устойчивы (кроме некоторых белков).
Знак заряда гранулы может меняться при смене растворителя, а также при изменении среды раствора. У амфотерного гидроксида алюминия знак заряда гранулы в кислотной и нейтральной средах положителен и потенциалопределяющими являются ионы алюминия; в слабощелочной среде знак заряда гранулы становится отрицательным (потенциалопределяющие ионы – алюминат- или гидроксид-ионы, противоионы – катионы). Смена знака заряда происходит при переходе через значение рН, соответствующее изоэлектрической точке.
Знак заряда коллоидной частицы устанавливается по направлению ее движения к соответствующему электроду при пропускании постоянного электрического тока. Знак заряда может быть определен другим очень простым способом – по характеру взаимодействия окрашенных коллоидных частиц с целлюлозой бумаги. В водной среде капилляры целлюлозы заряжаются отрицательно, а находящаяся в них вода – положительно. Вдоль полоски фильтровальной бумаги (целлюлоза) по ее капиллярам могут передвигаться частицы, имеющие тот же заряд, что и целлюлоза, т.е. отрицательно заряженные частицы. Положительно заряженные частицы задерживаются на стенках капилляров в самом начале пути.
При исследовании бесцветного коллоидного раствора пропитанную раствором бумагу следует высушить и обработать реактивом, окрашивающим коллоидные частицы. Подобный анализ представляет собой вариант хроматографического анализа на бумаге.
Положительный знак заряда имеют гранулы гидроксидов Fe(OH)3, Al(OH)3, Cr(OH)3, Ti(OH)3 и др. Отрицательный знак заряда имеют гранулы некоторых гидроксидов, оксидов MnO2, SnO2, SiO2, золи кремниевой кислоты, сульфидов As2S3, PbS и других, коллоиды высокодисперсных металлов Au, Ag, Pt и серы S, а также глинистые коллоиды и гуминовые кислоты почвы.
Явления смещения диффузного слоя в мицелле и даже его отрыва или, наоборот, возникновения разности потенциалов при движении мицеллы называют электрокинетическими явлениями. Все электрокинетические явления связаны с наличием двойного электрического слоя и определяются электрокинетическим потенциалом. Эти явления наблюдаются в дисперсных системах и в капиллярах и связаны с подвижностью диффузного слоя ионов. На электрокинетических явлениях основаны некоторые методы очистки воды. Из этих явлений наиболее важны электроосмос и электрофорез.
Движение дисперсных частиц относительно дисперсионной среды (жидкой и газообразной) под действием электрического поля называется электрофорезом. В водной среде частица двигается к электроду, знак заряда которого противоположен знаку электрокинетического потенциала.
Диффузный слой ионов мицеллы непрочен, при перемещении мицеллы происходит его частичное разделение, при этом дисперсная фаза и дисперсионная среда приобретают противоположные заряды. В электрическом поле гранула перемещается к одному полюсу, а часть противоионов диффузного слоя отрывается от мицеллы и передвигается к противоположному полюсу.
В отличие от электролиза при электрофорезе не происходит выделения дисперсного вещества, мицеллы не разрушаются, а наблюдается концентрирование коллоидных примесей с последующим удалением их из приэлектродной зоны.
Электроосмос – перемещение дисперсионной среды под действием электрического поля: противоионы диффузного слоя притягиваются к соответствующему электроду и увлекают за собой жидкость дисперсионной среды.
|
из
5.00
|
Обсуждение в статье: ЛИОФИЛЬНЫЕ И ЛИОФОБНЫЕ ЗОЛИ |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

