 |
Главная |
Концентрация реагентов
|
из
5.00
|
Увеличение концентрации реагирующих веществ приводит к возрастанию числа молекул, обладающих достаточной для реакции энергией и к росту частоты их столкновений. Рассмотрим реакцию между двумя разными молекулами А и В:
А + В →АВ
Удвоение концентрации [А] или [В] по отдельности приведет к увеличению скорости реакции в два раза, а одновременное удвоение концентраций [А] и [В] повысит вероятность их столкновений вчетверо и скорость реакции возрастет в четыре раза (квадратные скобки используют для выражения содержания реагирующих веществ в молярной концентрации). Следовательно, скорость реакции пропорциональна концентрациям реагирующих молекул. Зависимость скорости реакции от концентрации реагентов принимает вид:
скорость реакции ≈ [реагирующие вещества],
или в данном конкретном случае:
скорость реакции ≈ [А][В].
Для реакции, которая протекает в такой стехиометрии, когда на образование продукта затрачивается одна молекула вещества А и две молекулы вещества В:
А + 2В → АВ2
выражение для скорости реакции примет вид:
скорость реакции ≈ [А][В][В],
или
скорость реакции ≈ [А][В]2.
В самом общем случае, когда n молекул вещества А реагирует с m молекулами вещества В:
nA + mB → AnBm
выражение для скорости реакции принимает вид:
скорость реакции ≈ [А]n[В]m.
Температура
С повышением температуры, в пределах некоторого весьма ограниченного интервала температур, скорость реакций, катализируемых ферментами, увеличивается. Коэффициент, показывающий, во сколько раз увеличивается скорость реакции при повышении температуры на 10°, называется температурным коэффициентом Вант-Гоффа и обозначается Q10. Для большинства химических реакций, а также многочисленных биохимических реакций повышение температуры на 10° приводит к увеличению скорости процесса в 2-3 раза (т.е. коэффициент Q10 равен 2-3) и, аналогично, при понижении температуры на 10° скорость уменьшается в 2-3 раза. Многие физиологические процессы (например, скорость сокращения изолированной сердечной мышцы) также подчиняются этому правилу. Типичная зависимость скорости ферментативной реакции от температуры представлена на рис. 5.5.
Как можно видеть из графика, при некой оптимальной температуре скорость реакции максимальна. Рост скорости реакции по мере приближения температуры к оптимальному значению объясняется увеличением кинетической энергии реагирующих молекул, т.е. увеличением частоты сталкивания молекул фермента и субстрата. При дальнейшем росте температуры кинетическая энергия молекул самих ферментов оказывается достаточной для разрыва внутримолекулярных связей, поддерживающих их вторичную и третичную структуры в необходимом каталитически активном состоянии, что приводит к потере их каталитической активности.

| Рис. 5.5. | Влияние температуры на скорость гипотетической ферментативной реакции. Относительная активность ферментативной реакции как функция температуры. Снижение активности при температуре свыше 50°С обусловлено термической денатурацией фермента. |
Для большинства ферментов оптимальной температурой является та температура, при которой в норме функционируют клетки. Для ферментов некоторых микроорганизмов, адаптировавшихся к обитанию в естественных горячих источниках, оптимальная температура может быть близка к точке кипения воды.
Значение рН среды
Активность ферментов зависит от рН раствора, в котором протекает ферментативная реакция. Для каждого фермента существует оптимальное значение рН, при котором наблюдается его максимальная активность. Это связано с ионизацией функциональных групп аминокислотных остатков фермента, обеспечивающих оптимальную конформацию его активного центра.
Оптимум рН для большинства ферментов организма человека совпадает с его физиологическим значением и находится в интервале 6,0-8,0 (рис. 5.6).

| Рис. 5.6. | Зависимость начальной скорости реакции, катализируемой глюкозо-6-фосфатазой от рН среды. |
Вместе с тем отдельные ферменты активны при значениях рН, лежащих далеко за пределами этого интервала, например наибольшую активность пепсин проявляет при рН 2,0, трипсин – при рН 7, а папаин вообще не чувствителен к изменению рН в диапазоне от 4,0 до 8,0 (рис. 5.7).
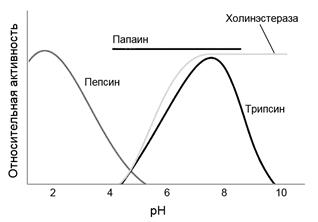
| Рис. 5.7. | Зависимости активностей пепсина, трипсина, папаина и холинэстеразы от рН среды. Трипсин имеет слабощелочное значение рН, в то время как пепсин, действующий в сильнокислой среде желудка, имеет оптимум рН около 2. Папаин – протеиназа обнаруженная у папайи не чувствителен к изменению рН в диапазоне от 4,0 до 8,0. На активность холинэстеразы влияет рН среды ниже 7,0. В диапазоне рН от 7,0 до 10,0 активность холинэстеразы не изменяется, что указывает на особое значение для активности этого фермента ионизуемых групп с рК′ ниже 6,0. |
При отклонении рН от оптимальных значений происходит изменение ионизации функциональных групп молекулы фермента. Например, в кислой среде происходит протонирование свободных аминогрупп (–NH3+), а в щелочной – отщепление протона от карбоксильных групп (–СОО–). Это приводит к изменению конформации фермента и его активного центра. Следовательно, нарушается способность активного центра связывать субстраты, коферменты. Кроме того, рН среды может влиять на степень ионизации или пространственную организацию субстрата, что также влияет на сродство субстрата к активному центру. При значительном отклонении от оптимального значения рН может происходить денатурация белковой молекулы с полной потерей ферментативной активности.
|
из
5.00
|
Обсуждение в статье: Концентрация реагентов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

