 |
Главная |
Абсолютная температура. Шкала температур Кельвина
|
из
5.00
|
Понятие абсолютной температуры было введено У. Томсоном (Кельвином), в связи с чем шкалу абсолютной температуры называют шкалой Кельвина или термодинамической температурной шкалой. Единица абсолютной температуры — кельвин (К). Абсолютная шкала температуры называется так, потому что мера основного состояния нижнего предела температуры — абсолютный ноль, то есть наиболее низкая возможная температура, при которой в принципе невозможно извлечь из вещества тепловую энергию. Абсолютный ноль определён как 0 K, что равно −273.15 °C.
2.Шкала Цельсия
В технике, медицине, метеорологии и в быту в качестве единицы измерения температуры используется шкала Цельсия. В настоящее время в системе СИ термодинамическую шкалу Цельсия определяют через шкалу Кельвина: t(°С) = Т(К) — 273,15 (точно), т. е. цена одного деления в шкале Цельсия равна цене деления шкалы Кельвина.
3.Шкала Фаренгейта
В Англии и, в особенности, в США используется шкала Фаренгейта. Ноль градусов Цельсия — это 32 градуса Фаренгейта, а 100 градусов Цельсия — 212 градуса Фаренгейта.
В настоящее время принято следующее определение шкалы Фаренгейта: это температурная шкала, 1 градус которой (1 °F) равен 1/180 разности температур кипения воды и таяния льда при атмосферном давлении, а точка таяния льда имеет температуру +32 °F. Температура по шкале Фаренгейта связана с температурой по шкале Цельсия (t °С) соотношением t °С = 5/9 (t °F — 32), t °F = 9/5 t °С + 32. Предложена Г. Фаренгейтом в 1724 году.
4.Шкала Реомюра
Предложена в 1730 году Р. А. Реомюром, который описал изобретённый им спиртовой термометр.
Единица — градус Реомюра (°Ré), 1 °Ré равен 1/80 части температурного интервала между опорными точками — температурой таяния льда (0 °Ré) и кипения воды (80 °Ré)
1 °Ré = 1,25 °C.
Связь температуры с кинетической энергией и скоростью движения молекул. 
26. Уравнение Менделеева-Клайперона
Уравнение состояния идеального газа (иногда уравнение Клапейрона илиуравнение Менделеева — Клапейрона) — формула, устанавливающая зависимость между давлением, молярным объёмом и абсолютной температурой идеального газа. Уравнение имеет вид:
 ,
,
где
 — давление,
— давление,
 — молярный объём,
— молярный объём,
 — универсальная газовая постоянная
— универсальная газовая постоянная
 — абсолютная температура, К.
— абсолютная температура, К.
Так как  , где
, где  — количество вещества, а
— количество вещества, а  , где
, где  — масса,
— масса,  —молярная масса, уравнение состояния можно записать:
—молярная масса, уравнение состояния можно записать:

 где
где 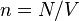 — концентрация атомов,
— концентрация атомов,  — постоянная Больцмана.
— постоянная Больцмана.
В случае постоянной массы газа уравнение можно записать в виде:

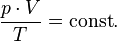
Последнее уравнение называют объединённым газовым законом. Из него получаются законы Бойля — Мариотта, Шарля и Гей-Люссака:
 — закон Бойля — Мариотта.
— закон Бойля — Мариотта.
 — Закон Гей-Люссака.
— Закон Гей-Люссака.
 — закон Шарля (второй закон Гей-Люссака, 1808 г.)
— закон Шарля (второй закон Гей-Люссака, 1808 г.)
А в форме пропорции  этот закон удобен для расчёта перевода газа из одного состояния в другое.
этот закон удобен для расчёта перевода газа из одного состояния в другое.

Закон Авогадро — закон, согласно которому в равных объёмах различных газов, взятых при одинаковых температурах и давлениях, содержится одно и то же число молекул. В виде гипотезы был сформулирован в 1811 году Амедео Авогадро (1776 — 1856), профессором физики в Турине. Гипотеза была подтверждена многочисленными экспериментальными исследованиями и поэтому стала называться законом Авогадро, став впоследствии (через 50 лет, после съезда химиков в Карлсруэ) количественной основой современной химии (стехиометрии).
27. Основное уравнение МКТ.
 . Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).
. Основное уравнение МКТ связывает макроскопические параметры (давление, объём, температура) термодинамической системы с микроскопическими (масса молекул, средняя скорость их движения).

ДАВЛЕНИЕ ГАЗА.Сила, с которой давит газ, стремясь к расширению под действиемтеплового движения его молекул; оно выражается обычно в кгс/см2, или в атм (1 атм соответствует давлению1,03 кгс/см2).
28. Изопроцесс при постоянной температуре.
Изотермический процесс.
Изотермический процесс — процесс изменения состояния термодинамической системы при постоянной температуре ( 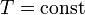 ). Изотермический процесс в идеальных газах описывается законом Бойля — Мариотта:
). Изотермический процесс в идеальных газах описывается законом Бойля — Мариотта:
При постоянной температуре и неизменных значениях массы газа и его молярной массы, произведение объёма газа на его давление остаётся постоянным: PV = const.
29. Внутренняя энергия — принятое в физике сплошных сред, термодинамике и статистической физике название для той части полной энергии термодинамической системы, которая не зависит от выбора системы отсчета и которая в рамках рассматриваемой проблемы может изменяться.
|
из
5.00
|
Обсуждение в статье: Абсолютная температура. Шкала температур Кельвина |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

