 |
Главная |
Теоретическое введение. Раствором называется гомогенная система переменного состава
|
из
5.00
|
Раствором называется гомогенная система переменного состава, образованная двумя или несколькими компонентами. Одним из компонентов раствора является растворитель, другим (или другими) – растворенное вещество.
Количественное соотношение между растворителем и растворенным веществом выражается концентрацией. Применяются несколько способов выражения концентраций растворов:
Процентная концентрация C% – отношение массы растворенного вещества к массе раствора.
 ,
,
где m – масса раствора;
mA – масса растворенного вещества;
mB – масса растворителя.
Молярная доля N – отношение числа молей растворенного вещества к сумме числа молей растворенного вещества и растворителя.
 ,
,
где nA – число молей растворенного вещества;
nB – число молей растворителя.
Число молей вещества равно отношению массы вещества m к его молярной массе М
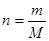 .
.
Молярная концентрация СМ – отношение количества растворенного вещества к объему раствора или число молей растворенного вещества в 1 л (1 дм3) раствора.
 ,
,
где V – объем раствора, л.
Моляльная концентрация  - отношение количества растворенного вещества к массе растворителя или число молей растворенного вещества в 1000 г растворителя.
- отношение количества растворенного вещества к массе растворителя или число молей растворенного вещества в 1000 г растворителя.

Нормальная концентрация CN – отношение количества эквивалентов растворенного вещества к объему раствора или число молей эквивалентов растворенного вещества в 1 л (1 дм3) раствора.
 ,
,
где nЭ – число молей эквивалентов.
Число молей эквивалентов вещества равно отношению массы вещества m к массе моля эквивалентов вещества mЭ

 .
.
Примеры расчета массы моля эквивалентов mЭ для различных веществ приведены в таблице 3.
Согласно закону эквивалентов вещества взаимодействуют в эквивалентных количествах.
n  = n
= n 
Для веществ, реагирующих в растворах, закон эквивалентов можно записать в виде:
 ,
,
где  и
и  - нормальные концентрации взаимодействующих растворов 1 и 2;
- нормальные концентрации взаимодействующих растворов 1 и 2;
V1 и V2 – объемы растворов 1 и 2.
Табл.3
Примеры расчета массы моля эквивалентов mЭ для различных классов соединений
| Кислота | Основание | Соль |


| 
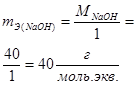
| 

|
Для оценки реакции среды в растворах пользуются величиной водородного показателя рН. По определению водородный показатель равен отрицательному десятичному логарифму концентрации ионов водорода.
рН = - lg[H+],
где [H+] – концентрация ионов водорода, моль/л.
Если рН = 7 – среда нейтральная, рН < 7 – среда кислая, рН > 7 – щелочная среда.
Неизвестную концентрацию растворов можно определить методом титрования. Титрованием называется процесс контролируемого постепенного прибавления раствора известной концентрации (титранта) к раствору вещества, заданного объема, концентрацию которого нужно определить. Цель титрования заключается в добавлении титранта в количестве, эквивалентном количеству реагирующего с ним вещества. Это условие достигается в точке эквивалентности (т.э.).
Выполнение опытов
|
из
5.00
|
Обсуждение в статье: Теоретическое введение. Раствором называется гомогенная система переменного состава |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

