 |
Главная |
Стандартные электродные потенциалы металлов. Ряд напряжений
|
из
5.00
|
Стандартный электродный потенциал металла - электродный потенциал, возникающий при погружении металла в раствор собственной соли с концентрацией ионов металла, равной 1 моль/л, измеренный по сравнению со стандартным водородным электродом, потенциал которого при 250С и давлении 1 атм условно принят равным нулю.
Для определения относительного значения электродного потенциала какого-либо металла составляют гальванический элемент, одним электродом которого является электрод из данного металла, погруженный в раствор его соли, другим - стандартный водородный электрод. Электродвижущую силу такого гальванического элемента легко измерить. Она и будет величиной стандартного потенциала металла, так как стандартный потенциал водородного электрода равен нулю.
Стандартный электродный потенциал - мера электрохимической активности металла.
Располагая металлы в ряд по мере возрастания алгебраической величины их стандартных электродных потенциалов, получаем так называемый « Ряд стандартных потенциалов»
Положение металла в ряду стандартных потенциалов характеризует его восстановительную способность, а также окислительные свойства его ионов в водных растворах при стандартных условиях. Чем меньше значение алгебраической величины стандартного электродного потенциала, тем большими восстановительными свойствами обладает данный металл в виде простого вещества, и тем меньше окислительные способности проявляют его ионы и наоборот.
Величина электродного потенциала металла зависит не только от природы металла, но и от концентрации ионов металла в растворе и температуры (зависимость выражается уравнением Нернста):
0,059lg CMen+
 Е Ме/Меn+ = Е0Ме/Меn+ +
Е Ме/Меn+ = Е0Ме/Меn+ +
n
Из уравнения видно, что при С =1 моль/л ЕМе/Меn+ = Е0Ме/Меn+ , т.е равновесный электродный потенциал равен его стандартному потенциалу.
3. Гальванический элемент- это устройство, и котором химическая энергия окислительно-восстановительной реакции превращается в электрическую (возникает электрический ток).
Электроды в гальваническом элементе две металлические пластинки: на электроде из более активного металла происходит окисление атомов металла в ионы (растворение металла), при этом электроны поступают во внешнюю цепь; на электроде из менее активного металла происходит восстановление его ионов из раствора в атомы, которые осаждаются на электроде.
Одновременно часть анионов в растворе переходит по электролитическому ключу в сосуд с раствором соли более активного металла. Поскольку электроны восстановителя передаются окислителю по проводнику, то химическая энергия реакции превращается в электрическую.
Электрический ток в гальваническом элементе обусловлен направленным движением электронов (во внешней цепи) и анионов (во внутренней цепи).
Следует различать знаки электродов и их названия. Название электродам дается в соответствии с процессами, которые на них протекают: электрод, на котором происходит процесс окисления называется анодом, а электрод на котором происходит процесс восстановления - катодом.
Анод в гальваническом элементе принято считать отрицательным, а катод - положительным.
Гальванический элемент (рис.2) обычно изображают краткой электрохимической схемой или в ионном виде.
Краткая электрохимическая схема этого гальванического элемента:



 (-) Mg Mg(NO3)2 Zn(NO3)2 Zn (+)
(-) Mg Mg(NO3)2 Zn(NO3)2 Zn (+)
 |  |  |  |
Ионный вид схемы: А(-) Mg Mg2+ Zn2+ Zn (+) К
Одна вертикальная линия означает границу между электродом и раствором, две вертикальные линии - границу между растворами, в скобках указаны знаки электродов.
Исходя из положения металлов в ряду стандартных потенциалов, находим , что магний является более активным металлом ( Е0 Mg/Mg2+ = - 2,36 В), чем цинк (Е0 Zn/Zn2+= - 0,76В), следовательно, процесс окисления будет происходить на магниевом электроде, а процесс восстановления - на цинковом.



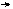
 е е
е е














 Mg 2 Zn
Mg 2 Zn
 |  |  | |||||||||||
 |  |  |  | ||||||||||

 NO3-
NO3-











 - _- -_ -_ -_- _ -_ -_
- _- -_ -_ -_- _ -_ -_


 -_ -_ _ -_-_-_ 1 -_-_ _ _ -_-_
-_ -_ _ -_-_-_ 1 -_-_ _ _ -_-_


 -_-_-_-_-_-_- -_-_-_-_-_-_-_
-_-_-_-_-_-_- -_-_-_-_-_-_-_



 - - - - - - - - - - - - - - - - - - - -
- - - - - - - - - - - - - - - - - - - -
Mg(NO3)2 Zn(NO3)2
Рис.2 Гальванический элемент: 1 - микростаканчики;
2 - электролитный мостик; 3- гальванометр.
Процессы, происходящие на электродах при работе гальванического элемента представляют электронными уравнениями:
 А (-) Mg0 - 2 e = Mg2+ - окисление
А (-) Mg0 - 2 e = Mg2+ - окисление
 К (+) Zn2+ + 2 e = Zn0 - восстановление
К (+) Zn2+ + 2 e = Zn0 - восстановление
--------------------------------------------------------
Mg0 + Zn2+ = Mg2+ + Zn0
Суммируя процессы, происходящие на электродах, получим то же уравнение реакции, что и при взаимодействии магния с раствором нитрата цинка: Mg + Zn(NO3)2 = Mg(NO3)2 + Zn . Разница в том, что при взаимодействии магния с раствором нитрата цинка электроны переходят от магния к ионам цинка, т.е. от восстановителя к окислителю непосредственно , а при работе гальванического элемента - по внешнему проводнику, т.е. процессы окисления и восстановления пространственно разделены.
Причиной возникновения и протекания электрического тока в гальваническом элементе является разность электродных потенциалов.
Электродвижущую силу (Э.Д.С.) любого гальванического элемента можно вычислить по разности электродных потенциалов катода и анода. Так, для магниево-цинкового гальванического элемента находим:
Э.Д.С. = Е0Zn/Zn2+ - E0Mg/Mg2+ = (-0,76) - (-2,36) = +1,60 В.
Главный критерий возможности самопроизвольного протекания реакции в гальваническом элементе - положительное значение Э.Д.С.
4. Коррозия металлов - это самопроизвольный процесс разрушения металлов под воздействием окружающей среды.
По механизму протекания коррозийного разрушения различают два типа коррозии - химическую и электрохимическую.
Химической коррозией называется разрушение металла окислением его в окружающей среде без возникновения электрического тока в системе: в этом случае происходит взаимодействие металла с составными частями среды - с газами и неэлектролитами.
Электрохимической коррозией называется разрушение металла в среде электролита с возникновением внутри системы электрического тока. В этом случае наряду с химическими процессами (отдача электронов) протекают и электрические (перенос электронов от одного участка к другому).
Электрохимическую коррозию вызывают главным образом загрязнения, примеси, содержащиеся в металле, или неоднородности его поверхности, а также контакт двух металлов. В этих случаях при соприкосновении металла с электролитом (электролитом может быть влага, адсорбируемая из воздуха) на его поверхности возникает множество короткозамкнутых микрогальванических элементов, в которых анодами являются частицы металла, катодами - загрязнения , примеси. Аноды растворяются, на катодах происходит связывание электронов.
Таким образом, при электрохимической коррозии (как в случае контакта разнородных металлов, так и в случае образования гальванических микроэлементов на поверхности одного металла) поток электронов направлен от более активного металла (с меньшей величиной электродного потенциала) к менее активному проводнику (с большей величиной электродного потенциала) и более активный металл корродирует (окисляется).
Окислители, принимающие электроны у катода, называются катодными диполяризаторами. Катодными диполяризаторами служат ионы водорода Н+ (в кислой среде) и кислород воздуха, всегда содержащийся в воде и ее растворах. Таким образом, в кислой среде на катоде происходит восстановление ионов водорода (выделяется молекулярный водород), в нейтральной и щелочной средах происходит восстановление кислорода, а водород не выделяется:
 О2 + 2Н2О + 4 е = 4 ОН-
О2 + 2Н2О + 4 е = 4 ОН-
Пример: Какой металл будет коррозировать во влажном воздухе, если хром находиться на контакте с медью?
Составить схему гальванического элемента, работающего при коррозии металлов.
Исходя из положения металла в ряду стандартных потенциалов, находим, что хром является более активным металлом (Е0Cr/Cr3+ = - 0.74 B), чем медь (Е0Cu/Cu2+ = + 0,34 В), и в образующейся паре Cr будет анодом, а катодом - медь. Катодным деполяризатором является кислород. Хромовый анод растворяется, а на медном катоде идет восстановление кислорода.
Схема работающего гальванического элемента:
 е
е
 |
Анод (-) Cr H2O ; O2 Cu (+) Катод
 |
 А (-) 4 Cr0 - 3 e = Cr 3+ - окисление
А (-) 4 Cr0 - 3 e = Cr 3+ - окисление

 К (+) 3 О2 + 2Н2О + 4 е = 4ОН -восстановление
К (+) 3 О2 + 2Н2О + 4 е = 4ОН -восстановление
 ----------------------------------------------
----------------------------------------------
4 Cr0 + 3 O2 + 6 H2O = 4 Cr3+ +12 OH
 |
Cr3+ + 3 OH = Cr (OH)3 , следовательно корродирует хром.
|
из
5.00
|
Обсуждение в статье: Стандартные электродные потенциалы металлов. Ряд напряжений |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

