 |
Главная |
Изучение работы спектроскопа и наблюдения оптических спектров
|
из
5.00
|
Цель работы: знакомство с элементами теории строения и излучения атомов, знакомство со строением и работой спектроскопа, градуировка шкалы спектроскопа и определение длины волны излучения натрия.
1.Краткие теоретические сведения
Электромагнитное излучение, распространяясь в веществе, взаимодействует с его атомами и молекулами, и прошедшее излучения несет информацию о молекулярной структуре вещества и его энергетических состояниях.
При прохождении света через вещество часть энергии излучения поглощается, часть рассеивается, причем на разных частотах (длинах волн) поглощается и рассеивается разное количество электромагнитной энергии, в зависимости от строения и состава вещества. Поэтому, излучая спектры прошедшего и рассеянного излучения, можно определять вид, состав и концентрацию поглощающих и рассеивающих центров в исследуемом веществе.
Спектры испускания и поглощения вещества, лежащие в ультрафиолетовом, видимом и инфракрасном диапазонах, называют оптическими спектрами. Они отражают энергетические состояния атомов и молекул, поэтому весьма чувствительны к изменению химических связей, их окружения, РН среды, воздействию электрических и магнитных полей.
Спектры каждого вещества строго индивидуальны и являются его «паспортом», что позволяет по спектрам излучения определить вид вещества, его состав и процентное отношение компонентов смеси, т.е. провести качественный и количественный спектральный анализ.
Спектральный анализ является одним из важнейших неразрушающих методов исследования как структуры вещества, так и физических и химических процессов, происходящих в этом веществе на атомном и молекулярном уровнях и широко используется как метод исследования в физике, химии, молекулярной биологии и медицине.
Оптические спектры многих веществ были хорошо известны и систематизированы еще в XIX в.. Впервые правильное объяснение наблюдавшимся спектрам излучения и поглощения дал Н.Бор в начале ХХ в., основываясь на представлениях планитарной модели атома Э. Резерфорда и гипотезе М.Планка о квантовых свойствах света.
Постулаты Н.Бора.
1. Атомная система может находиться только в определенных энергетических состояниях Е1, Е2, Е3,…, Еn, в которых она не излучает и не поглощает энергию; эти состояния называют стационарными.
2. При переходе атома из одного стационарного состояния с энергией Еn в другое с энергией Еk, атом может излучать (если ЕnЕk ) либо поглощать (если Еn Еk) энергию в виде кванта электромагнитного поля 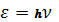 , равную:
, равную:
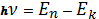 (1.1)
(1.1)
3. Стационарными являются состояния , в которых момент импульса электрона принимает значения, кратные величине
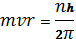 (1.2)
(1.2)
Постулаты Н.Бора дали возможность вычислить радиусы стационарных орбит и энергию электрона в этих состояниях для простейшего атома - атома водорода и водородоподобных ионов, т.е. имеющих только один электрон, и затем рассчитать их спектры излучения и поглощения.
Так радиусы стационарных орбит электрона в атоме водорода и водородоподобных ионов определяются по формуле:
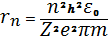 , (1.3)
, (1.3)
где n= 1.2.3,4, …-- номер электронной орбиты.
Радиус первой наименьшей боровской орбиты электрона в атоме водорода получим при n=1 и Z=1:
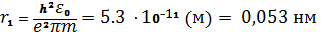 . (1.4)
. (1.4)
Полная энергия в атоме всегда отрицательна, что указывает на то, что электрон не свободен, а связан со своим ядром:
,
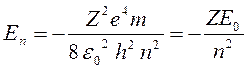 (1.5)
(1.5)
где 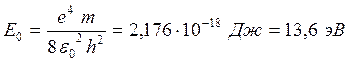 -- энергия атома водорода в основном состоянии т.е. энергия электрона на первой боровской орбите атома водорода.
-- энергия атома водорода в основном состоянии т.е. энергия электрона на первой боровской орбите атома водорода.
Таким образом наибольшую по модулю полную энергию электрон имеет на 1-й орбите, поэтому это энергетическое состояние является основным для электрона, а его энергетический уровень – самый нижний на энергетической диаграмме. Для атома водорода, в соответствии с постулатами Бора, энергия атома может принимать только вполне определенные значения, описываемые формулой:
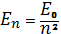 . (1.6)
. (1.6)
Положительное целое число n определяет радиусы стационарных орбит и энергию атома в этих состояниях и называется главным квантовым числом. Остальные энергетические состояния Е2, Е3 и т.д., имеют большую энергию и на диаграмме расположены выше ив обычных условиях свободны. Электрон может переходить в эти состояния лишь при поглощении необходимых порций энергии – квантов электромагнитного излучения в соответствии со вторым постулатом Бора. В таких состояниях электрон долго находиться не может и примерно через 10-9 с переходит в основное состояние, испуская кванты энергии. Частота излучения, испускаемого при переходе с энергетического уровня Еп на уровень Еk. определяется правилом частот Бора:
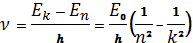 , (1.7)
, (1.7)
где n=1, 2, 3, 4, … k=n+1, n+2, n+3, …
Эта формула, правильно описывающая частоты всех линий в спектре излучения атома водорода, была эмпирически установлена Бальмером для видимой области спектра водорода (для n= 2 и k=3,4,5,…)задолго до теории Бора,но теоретически не могла быть объяснена.
Положительное целое число n определяет радиусы стационарных орбит и энергию атома в этих состояниях и называется главным квантовым числом.
Набор частот электромагнитного излучения, которые может поглощать данный атом, определяют его спектр поглощения. При обратных переходах электрона из верхних, возбужденных энергетических состояний в более низкие или в основное состояние, атом излучает электромагнитные волны соответствующих частот, которые образуют его спектр испускания.
Совокупность спектральных линий, соответствующих переходам с любых верхних энергетических уровней на один и тот же нижний уровень, образует спектральную серию в излучении. В спектре атома водорода выделяют следующие основные спектральные серии:
1.Серия Лаймана возникает при переходах электронов со всех верхних уровней (k = 2, 3, 4,…) в основное состояние (n = 1). Частоты спектральных линий этой серии получают из формулы:
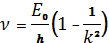 , (1.8)
, (1.8)
где k= 2, 3, 4, 5, …
Линии серии Лаймана лежат в ультрафиолетовой области спектра.
2. Серия Бальмера соответствует переходам на второй уровень n = 2 со всех верхних уровней (k = 3, 4, 5, ..). Их частоты определяются формулой Бальмера:
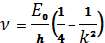 , (1.9)
, (1.9)
Линии серии Бальмера лежат в видимой области спектра.
3.Серия Пашена возникает при переходах со всех верхних уровней на тетий (n= 3):
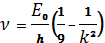 , (1.10)
, (1.10)
где k= 4, 5, 6, 7, …
Эта серия лежит в инфракрасной области спектра (рис.1.1).
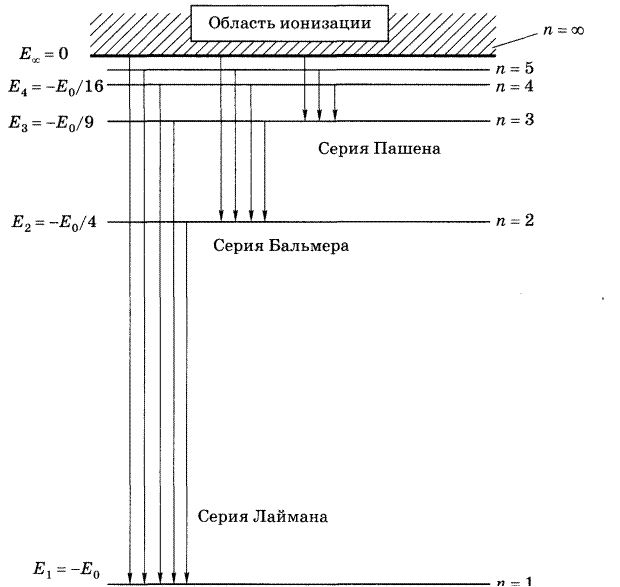
Рис.1.1 Диаграмма энергетических уровней атома водорода и схема образования основных спектральных серий в излучении атома водорода.

Рис.1.2 Схема расположения спектральных линий основных серий атома водорода.
Спектры атомов, состоящие из отдельных узких линий, называются линейчатыми (рис.1.2).
Прекрасное согласие Боровской теории атома водорода с экспериментом послужило весомым аргументом в пользу ее справедливости. Однако попытки внедрить эту теорию к более сложным атомам не увенчались успехом. Бор не смог дать физическую интерпретацию правилу квантования (это было сделано десятилетием позже де Бройлем на основе представлений о волновых свойствах электронов).но его теория послужила отправной точкой для развития более сложной теории атома –квантовой механики.
Атомы,имеющие на своих орбитах два и более электронов, называются сложными атомами.
В 1924 г. Луи де Бройль выдвинул гипотезу о том, что корпускулярно-волновым дуализмомобладают не только фотоны, но и движущиеся частицы. По гипотезе де Бройля, частицы вещества тоже имеют двойственный характер и могут вести себя как волна с определенной длиной. При этом количественные соотношения между корпускулярными и волновыми характеристиками частиц те же, что и для фотонов. Согласно гипотезе де Бройля, материальной частице массой m, движущейся со скоростью v (то есть имеющей импульс p=mv), соответствует монохроматическая волна - волна де Бройля, равная:
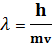 . (1.11)
. (1.11)
Де Бройль предположил, что каждая орбита в атоме соответствует волне, которая распространяется вокруг ядра атома. Стационарная орбита отвечает круговой стоячей волне де Бройля на длине орбиты. Это явление похоже на стационарную картину стоячих волн в струне с закрепленными концами.
Согласно квантовой механике, состояние электрона в атомах описывается четырьмя квантовыми числами: главным квантовым числом n, орбитальным квантовым числом l , магнитным квантовым числом m и спиновым числом 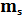 .
.
Главное квантовое число n определяет энергию электрона в атоме и может принимать последовательные целые значения от 1 и выше.
|
из
5.00
|
Обсуждение в статье: Изучение работы спектроскопа и наблюдения оптических спектров |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

