 |
Главная |
Установка нормальности и титра раствора HCl
|
из
5.00
|
Лабораторная работа №7
Тема: Приготовление и стандартизация раствора кислоты
Цель работы:научиться приготавливать и стандартизировать растворы кислот, закрепить умение проводить титрование, выполнять расчеты по результатам прямого титрования.
Методика выполнения лабораторного исследования
И оформление отчета
Предварительный расчет (для приготовления 250 мл раствора HCl
с молярной концентрацией эквивалента 0,1 моль/дм3):
Массу навески HCl mHCl г, рассчитывают по формуле:
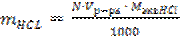 (для 100%-ной кислоты)
(для 100%-ной кислоты)
где N – молярная концентрация эквивалента раствора HCl, моль/дм3,
Vр-ра – заданный объем стандартного раствора HCl, мл,
МэквHCl – молярная масса эквивалента HCl, г/моль.
mHCl =
Данные о плотности и концентрации раствора соляной кислоты получить у лаборанта.
Рассчитываем навеску кислоты mн г, по формуле:
100 – А
mн – mHCl
mн = 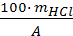 =
=
где mHCl – масса навески HCl, г,
А – концентрация HCl, %.
Зная навеску концентрированной кислоты, найдем ее объем. Объем кислоты Vкисл мл, находим по формуле:
Vкисл = 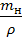 =
=
где mн – навеска кислоты, г,
 - плотность кислоты, г/см3.
- плотность кислоты, г/см3.
Полученные данные оформляют в виде таблицы:
| Величина | Значение |
| Заданный объем стандартного раствора HCl, мл | |
| Плотность концентрированной кислоты (ρ), г/см3 | |
| Массовая доля концентрированной кислоты (A), % | |
| Объём раствора концентрированной кислоты, мл |
Приготовление раствора кислоты:
В чистую склянку с меткой наливают дистиллированную воду около 50 мл. Затем туда же выливают отмеренный объём концентрированной соляной кислоты, доводят водой уровень раствора до метки. Склянку закрывают пробкой, осторожно многократно перемешивают. Наклеивают этикетку, на которой пишут химическую формулу приготовленной кислоты и свою фамилию.
Приготовленный таким образом раствор НСl имеет приблизительную концентрацию, поэтому его нельзя использовать в качестве стандартного раствора до момента установления точной концентрации.
Чтобы установить точную концентрацию приготовленного раствора НСl, можно применять химически чистые соединения известного химического состава, реагирующие с кислотой в стехиометрических соотношениях.
Чаще всего для этого используют тетраборат натрия (буру) Na2B4O7 ·10H2O (х.ч.) или безводный карбонат натрия (безводную соду) Na2CO3 (х. ч.)
Установка нормальности и титра раствора HCl
по исходному раствору тетрабората натрия (буры) Na2B4O7·10H2O
Готовят раствор х.ч. буры строго определенной концентрации. Предварительно рассчитывают количество х.ч. Na2B4O7·10H2O для приготовления раствора, нормальность которого приблизительно равна нормальности рабочего раствора кислоты.
МэквNa2B4O7·10H2O = 190,71 г/моль. Для приготовления 100 мл раствора с молярной концентрацией эквивалента 0,1 моль/дм3 необходимо 1,9071 г буры.
На аналитических весах взвешивают 1,9071 г буры.
Результаты взвешивания оформить следующим образом:
mнавески расчетная = 1,9071 г
mпробирки на технических весах =
mпробирки с навеской на технических весах =
mпробирки с навеской на аналитических весах =
mпробирки на аналитических весах =
mточная навески =
Навеску пересыпать в мерную колбу на 100 мл. Бура плохо растворяется в холодной воде, поэтому для ее растворения надо взять небольшое количество горячей воды. Добившись полного растворения буры в горячей воде, доливают холодную воду до метки и тщательно перемешивают полученный раствор, плотно закрыв колбу пробкой. По навеске рассчитывают нормальность полученного раствора. Молярную концентрацию раствора буры Nбуры моль/дм3, рассчитывают по формуле:
Nбуры = mбуры ∙1000=
 Vм.к. ∙ Мэкв.буры
Vм.к. ∙ Мэкв.буры
где mбуры – масса навески, г,
Vм.к. – объем мерной колбы, мл,
Мэкв.буры – молярная масса эквивалента буры, г/моль.
Нормальность раствора кислоты HCl устанавливают прямым титрованием исходного раствора Na2B4O7·10H2O. Титруют следующим образом. Пипеткой отмеряют 20-25 мл раствора буры, вливают в коническую колбу и прибавляют 1-2 капли раствора метилового оранжевого. Из бюретки, непрерывно помешивая, приливают раствор кислоты до тех пор, пока раствор буры не окрасится в бледно-розовый цвет. Титрование повторяют 3 раза. Результаты титрования заносят в таблицу.
| Показатель | Значение |
| Нормальность раствора Na2B4O7·10H2O, моль/дм3 | |
| Объем мерной колбы, мл | |
| Аликвотный объем раствора Na2B4O7·10H2O, мл | |
| Объем раствора HCl, пошедший на: 1-е титрование 2-е титрование 3-е титрование | |
| Средний объем раствора HCl, мл | |
| Нормальность раствора HCl, моль/дм3 | |
| Титр раствора HCl, г/см3 |
Расчет:
1. рассчитываем молярную концентрацию эквивалента раствора кислоты NHCl моль/дм3, по формуле
NHCl = 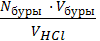 =
=
где Nбуры - молярная концентрация эквивалента раствора буры, моль/дм3,
Vбуры – объем буры, взятый для титрования, мл,
VHCl – объем кислоты, пошедший на титрование, мл
2. рассчитываем титр раствора кислоты ТHCl г/см3, по формуле:
ТHCl = 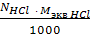 =
=
где NHCl - молярная концентрация эквивалента раствора HCl, моль/дм3,
МэквHCl – молярная масса эквивалента HCl, г/моль.
Контрольные вопросы:
1. Перечислите вещества, используемые для установки точной концентрации приготовленного раствора НСl;
2. Объясните, как производится установка титра раствора HCl;
3. Опишите процесс приготовления стандартного раствора кислоты;
4. Опишите правила пользования денсиметром;
5. Составьте формулы для расчета нормальности и титра раствора кислоты, нормальности тетрабората натрия;
6. Рассчитайте молярную массу эквивалента для Na2B4O7·10H2O и HCl
7. Составьте уравнение реакции между Na2B4O7·10H2O и HCl.
8. Сделайте заключение о возможном применении метода нейтрализации в пищевой промышленности
Список литературы:
1. Ольшанова, К. М. Аналитическая химия: учебник / К. М. Ольшанова, С. К. Пискарёва, К. М. Барашкова. – М.: Химия, 1990. – с.296-298.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.241-245.
|
из
5.00
|
Обсуждение в статье: Установка нормальности и титра раствора HCl |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

