 |
Главная |
Приготовление раствора крахмала
|
из
5.00
|
Лабораторная работа №13
Тема:Приготовление и стандартизация раствора натрий тиосульфата
Цель работы:научиться приготавливать раствор натрий тиосульфата и стандартизировать его.
Общие положения:
Рассмотрим окислительно-восстановительные процессы в реакции между  и
и  .
.

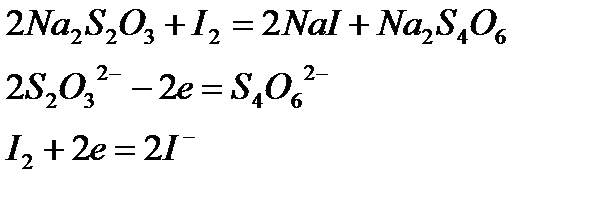
Т.к. два иона  теряют два электрона (по одному на каждый ион), то молярная масса эквивалента тиосульфата натрия равна его молярной массе:
теряют два электрона (по одному на каждый ион), то молярная масса эквивалента тиосульфата натрия равна его молярной массе:

Вычислить нормальность приготовленного раствора тиосульфата натрия по навеске его нельзя вследствие того, что кристаллы тиосульфата на воздухе выветриваются и поэтому химический состав их не всегда соответствует формуле  Раствор тиосульфата готовят приблизительной концентрации, а затем точно определяют его нормальность.
Раствор тиосульфата готовят приблизительной концентрации, а затем точно определяют его нормальность.
Методика выполнения лабораторного исследования
и оформление отчета:
Приготовление рабочего раствора тиосульфата натрия
Расчет навески тиосульфата натрия m Na2S2O3 г, для приготовления 150 мл 0,05 н. раствора:
 = NNa2S2O3· VNa2S2O3· М1/1 Na2S2O3= 0,05 · 0,15 · 248,18=
= NNa2S2O3· VNa2S2O3· М1/1 Na2S2O3= 0,05 · 0,15 · 248,18=
где NNa2S2O3 – нормальность раствора тиосульфата натрия, моль/дм3,
VNa2S2O3 – объем раствора тиосульфата натрия, дм3,
М1/1 Na2S2O3 – молярная масса эквивалента тиосульфата натрия, г/моль.
Навеску взвешивают на технохимических весах, затем пересыпают в стакан и растворяют в 150 мл дистиллированной воды.
Приготовление раствора крахмала
0,5 г растворимого крахмала тщательно взбалтывают в небольшом количестве холодной воды, смесь вливают тонкой струей в 100 мл кипящей воды, хорошо размешивают и кипятят 1-2 мин. Прибавляют 1г салициловой кислоты или хлорида цинка. После охлаждения раствор готов к употреблению.
Раствор крахмала хранят в колбе, закрытой ватой. Он должен быть однородным, без комков. Правильно приготовленный раствор крахмала должен давать синее окрашивание с 2-3 капли 0,01 н. раствора иода. Коричнево-бурая окраска раствора служит признаком разложения крахмала. Такой крахмал непригоден к употреблению.
3. Определение нормальности раствора тиосульфата натрия по титрованному раствору перманганата калия.
В три конические колбы для титрования отмеряют пипеткой 20 мл титрованного раствора перманганата калия, затем отмеривают мерным цилиндром в каждую колбу по 30 мл 2н раствора серной кислоты и 15 мл 10% раствора КI.
Протекает реакция:
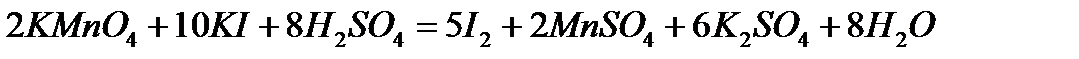
Смесь выдерживают 2-3 минуты, после чего добавляют 100-150 мл воды и титруют раствором тиосульфата натрия, помещенного в бюретку, сначала без индикатора до получения бледно-желтой окраски раствора, а затем, добавив 2-3 мл раствора крахмала, до полного обесцвечивания раствора.
Полученные результаты оформите в виде таблицы:
| N KMnO4 | V KMnO4 (мл) | V Na2S2O3 (мл) | Vср Na2S2O3 (мл) |
Расчеты:
Расчет нормальности тиосульфата натрия NNa2S2O3 моль/дм3, и титра тиосульфата натрия ТNa2S2O3 г/см3, ведут по формулам:
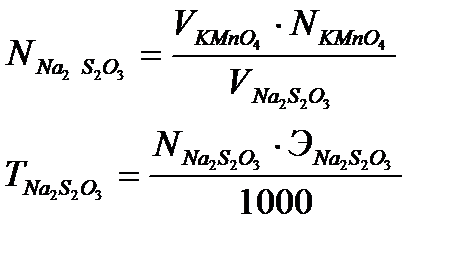
где VKMnO4 – объем раствора калий перманганата, взятый на титрование, мл,
NKMnO4 – нормальность раствора калий перманганата, моль/дм3,
VNa2S2O3 – объем раствора тиосульфата натрия на титрование, мл,
ЭNa2S2O3 - молярная масса эквивалента тиосульфата натрия, г/моль.
Контрольные вопросы:
1. Опишите роль KMnO4 в данной реакции.
2. Укажите, в какой среде ведется определение тиосульфата натрия, и рассчитайте молярную массу эквивалента KMnO4 в данной среде.
3. Объясните, почему раствор тиосульфата натрия готовят приблизительной концентрации?
4. Составьте уравнение химической реакции, лежащей в основе данного определения.
5. Рассчитайте молярную массу эквивалента тиосульфата натрия и объясните результат.
6. Сделайте вывод о возможном применении метода оксидиметрии в пищевой промышленности
7. Проанализируйте результаты титрования и сделайте заключение о погрешности титрования.
Список литературы:
1. Ольшанова, К. М. Аналитическая химия: учебник / К. М. Ольшанова, С. К. Пискарёва, К. М. Барашкова. – М.: Химия, 1990. – с.314-316.
2. Шапиро, М. А. Аналитическая химия: учебник / М. А. Шапиро, С. А. Шапиро. – М.: Высшая школа, 1979. – с.264-266.
|
из
5.00
|
Обсуждение в статье: Приготовление раствора крахмала |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

