 |
Главная |
Определение концентрации H2O2
|
из
5.00
|
2KI + H2O2 + H2SO4 ->I2+ K2SO4 + H2O
Определение активного хлора в хлорной извести. Белильная известь – один из самых сильных окислителей. Представляет собой смесь хлоридов (CaOCI2). В кислой среде она выделяет свободный активный хлор, который при обработке белильной извести KJ окисляет иодид ионы.
CaOCI2 + 2H+ => Ca2+ + CI2 + H2O
CI2 + 2J- => 2CI- + J2
Количество выделившегося иода эквивалентно количество и активного хлора: выделившийся иод затем оттитровывают тиосульфатом натрия:
J2 + 2S2O3 => 2J- + S4O62-
Затраченное количество тиосульфата натрия косвенно эквивалентно количеству активного хлора.
n(CI2)=n(J2)=n(Na2S2O3)
Эквивалент ОВР: М ок-вос делить на число принятых или отданных е
Cu + 2H2SO4 => CuSO4 + SO2 + 2H2O Э(Cu) = M/2 = 32г/экв
Сu0 – 2e => Cu2+, SO4 + 4H+ + 2e => SO2 + 2H2O Э(H2SO4) = M/2=49г/экв
2. Буферные растворы. Расчет phбуферных систем.
Буферные растворы представляют собой смеси слабой кислоты и ее соли, слабого основания и его соли либо смеси солей слабых многоосновных кислот.
CH3COOH+CH3COONa
NH4Oh+NH4Cl
NaH2PO4+Na2HPO4
Особенностью данных растворов явл то, что при прибавлении небольших количеств сильной кислоты или щелочи pH такого раствора практически не меняется.
Механизм действия буферного раствора рассмотрим на примере ацетатного буфера
CH3COOH+CH3COONa
При появлении в растворе избытка H+ (+кислоты) они связываются с ацетат-ионами, обр при диссоциации соли молекулы слабого электролита – уксусной кислоты.
При добавлении к раствору щелочи избыток OH- нейтрализуется в реакции с уксусной кислотой, обр молекулы слабого электролита – воды.
CH3COO-+H+↔CH3COOH
CH3COOH+OH-↔CH3COO-+H2O
Главной характеристикой буферных растворов является их pH и буферная емкость.
Рассчитаем pH ацетатного буфера.
Расчет основан на константе диссоциации уксусной кислоты:
CH3COOH↔CH3COO-+ H+(1)
Ka= 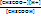 (2)
(2)
Выразим из ур(2) концентрацию [H+]
[H+]=Ka 
Т.к. соль – сильный электролит, то CH3COONa диссоциирует в растворе полностью и можно считать, что равновесная концентрация ацетат ионов = исходной концентрации соли в буферном растворе.
Как следует из ур. Диссоциации (1) присутствие в растворе ацетат ионов смещает равновесие в сторону обр молекул кислоты, т.е. можно считать, что равновесная концентрация кислоты = исходной концентрации кислоты в буферном растворе, тогда ур(3) может быть записано в след виде:
[H+]=Ka*  (4)
(4)
Прологарифмируем ур(4) и умножим на -1
-lg[H+]=-lgKa-lgCk+lgCc(5)
pH=pKa+lg  (6)
(6)
где pKa=-lgKa силовой показатель кислоты
рассуждая аналогично для буферных растворов, представляющих смесь для слабого основания и его соли, можно вывести формулу
pOH=pKb+lg  (7)
(7)
pKb силовой показатель слабого основания
Др важнейшей характеристикой буферного раствора явл его буферная емкость(В) – кол-во эквивалентов сильной кислоты или щелочи, кот можно дабавить к 1 л буферного раствора, чтобы изменить его pH на 1.
Буферная емкость опр эквивалентно титрованием пробы буферного раствора сильной кислотой или щельчью известной концентрации, фиксируя при этом изменение pH.
Рассчет буф емкости по кислоте и основанию ведут по формулам
Ва= 
Ba= 
|
из
5.00
|
Обсуждение в статье: Определение концентрации H2O2 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

