 |
Главная |
Классификация термодинамических систем.
|
из
5.00
|
Система– совокупность веществ, реально или условно выделенных из окружающей среды.
Классификация:
по однородности: гомо- и гетеросистемные.
1) Гомогенные системы- однородные системы, в которых нет частей, различающихся по свойствам, и различающихся по разделам.
2) Гетеросистема – система, состоящая из 2-х и более частей, различающихся по свойствам, и разделяющаяся границей фаз.
По характеру взаимодействия с окружающей средой:
1) изолированные(м=const, Q=const);
2) закрытая(m≠const, Q≠const)
10)Внутренняя энергия, теплота, работа. Определение, характеристика, и их взаимосвязь.Энтальпия системы и ее измерения.Тепловой эффект химической реакции.Энтропия и ее изменение при химической реакции.
Вну́тренняяэне́ргия системы- это сумма энергий теплового движения молекул и межмолекулярных взаимодействий.

где
-
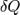 — подведённое к телу количество теплоты, измеренное в джоулях
— подведённое к телу количество теплоты, измеренное в джоулях -
 — работа, совершаемая телом против внешних сил, измеренная в джоулях
— работа, совершаемая телом против внешних сил, измеренная в джоулях - Для идеального газа внутренняя энергия равна:
-

Термодинамическая работа — способ передачи энергии, связанный с изменением внешних параметров системы.
Элементарная работа термодинамической системы над внешней средой:

Энергия, которую получает или теряет тело в процессе теплообмена с окружающей средой, называется коли́чеством теплоты́ или просто теплотой.
По первому закону термодинамика теплота:

Взаимосвязь: Смотрим на первый закон термодинамики.
Энтальпия системы и ее измерения.
Энтальпия системы – это функция состояния термодинамической системы при независимых параметрах энтропии S и давлении P, которая связана с внутренней энергией U соотношением
|
где V – объем системы.
В химии чаще всего рассматривают изобарические процессы (P = const), и тепловой эффект в этом случае называют изменением энтальпии системы или энтальпией процесса:
|
|
Тепловой эффект химической реакции. Термохимическое уравнение.
Тепловой эффект химической реакции или изменение энтальпии системы вследствие протекания химической реакции — отнесенное к изменению химической переменной количество теплоты, полученное системой, в которой прошла химическая реакция и продукты реакции приняли температуру реагентов.
Чтобы тепловой эффект являлся величиной, зависящей только от характера протекающей химической реакции, необходимо соблюдение следующих условий:
- Реакция должна протекать либо при постоянном объёме Qv(изохорный процесс), либо при постоянном давлении Qp(изобарный процесс).
- В системе не совершается никакой работы, кроме возможной при P = const работы расширения.
Если реакцию проводят при стандартных условиях при Т = 298,15 К = 25 ˚С и Р = 1 атм = 101325 Па, тепловой эффект называют стандартным тепловым эффектом реакции или стандартной энтальпией реакции ΔHrO.
Термохимические уравнения реакций- это уравнения, в которых около символов химических соединений указываются агрегатные состояния этих соединений или кристаллографическая модификация и в правой части уравнения указываются численные значения тепловых эффектов.
В термохимических уравнениях необходимо указывать агрегатные состояния веществ с помощью буквенных индексов, а тепловой эффект реакции (ΔН) записывать отдельно, через запятую. Например, термохимическое уравнение
4NH3(г) + 3O2(г) → 2N2(г) + 6H2O(ж), ΔН=-1531 кДж
показывает, что данная химическая реакция сопровождается выделением 1531 кДж теплоты, при давлении 101 кПа, и относится к тому числу молей каждого из веществ, которое соответствует стехиометрическому коэффициенту в уравнении реакции.
Энтропия и ее изменение при химической реакции.
Энтропия — мера хаотичности, беспорядка. Наиболее хаотичной формой существования вещества является газ, если химическая реакция протекает с увеличением числа молей газов в системе, то энтропия системы возрастает, и наоборот. Например, энтропия сильно увеличивается в реакции СаСО3=СаО+СО2 и уменьшается в реакции 2Н2+О2=2Н2О.
При протекании химической реакции кроме изменения энтропии системы необходимо учитывать её изменение в окружающей среде. Если систему и её окружение в совокупности рассматривать как единую изолированную систему, то, согласно второму закону термодинамики, для самопроизвольной химической реакции общее изменение её энтропии должно быть больше нуля:
DSобщ=DSсист+DSокр>0.
12) Закон Гесса. Следствие из закона Гессе. Термохимические расчеты.
Закон Гесса- Тепловой эффект (∆Н) химической реакции (при постоянных Р и Т) зависит от природы и физического состояния исходных веществ и продуктов реакции и не зависит от пути её протекания.
Следствие из закона Гессе.
1. Тепловые эффекты прямой и обратной реакций равны по величине и противоположны по знаку.
2. Тепловой эффект химической реакции (∆Н) равен разности между суммой энтальпий продуктов реакции и суммой энтальпий исходных веществ. 
Термохимические расчеты.
Тепловой эффект реакции (энтальпия реакции) при V=const или P=const не зависит от пути процесса (от числа промежуточных стадий), а определяется только начальным и конечным состоянием системы.
13)Энергия Гиббса и направленность химической реакции.
Энергия Гиббса — это величина, показывающая изменение энергии в ходе химической реакции:
 ;
;
Энергию Гиббса можно понимать как полную химическую энергию системы (кристалла, жидкости и т. д.)
Самопроизвольное протекание изобарно-изотермического процесса определяется двумя факторами: энтальпийным, связанным с уменьшением энтальпии системы (ΔH), и энтропийным T ΔS, обусловленным увеличением беспорядка в системе вследствие роста её энтропии.
Стандартная энергия Гиббса образованияDf°G298– изменение энергии Гиббса при образовании одного моля вещества из простых веществ при стандартных условиях (Т=298 К, р=1атм). Стандартные значения энергий Гиббса образования простых веществ в устойчивых модификациях равны нулю.
Изменение энергии Гиббса (G)D критерий, определяющий направление самопроизвольного протекания химических процессов:-
1) 0-<GDсамопроизвольный процесс принципиально осуществим;
2) GD>0-протекание химической реакции невозможно;
3)G = 0D – реакция находится в состоянии химического равновесия.
14)Химическое равновесие. Условия химического равновесия.Константа химического равновесия.Влияние температуры на константу химического равновесия.
Химическое равновесие — состояние химической системы, в котором обратимо протекает одна или несколько химических реакций, причём скорости в каждой паре прямая-обратная реакция равны между собой. Для системы, находящейся в химическом равновесии, концентрации реагентов, температура и другие параметры системы не изменяются со временем.
А2 + В2 ⇄ 2AB
Условие химического равновесия. Химическое равновесие зависит – от концентрации, давления, температуры. Итак, при повышении давления равновесие смещается в сторону уменьшения объема, при понижении давления – в сторону увеличения объёма.
Конста́нтаравнове́сия — величина, определяющая для данной химической реакции соотношение между термодинамическими активностями исходных веществ и продуктов в состоянии химического равновесия.
. 
Зная константу равновесия реакции, можно рассчитать равновесный состав реагирующей смеси, предельный выход продуктов, определить направление протекания реакции. Повышение либо понижение температуры означает либо приобретение либо потерю системой энергии, и изменяет константу равновесия.
Экзотермические реакции: ΔH < 0. В этом случае температурный коэффициент логарифма константы равновесия отрицателен. Повышение температуры уменьшает величину константы равновесия, т.е. смещает равновесие влево.
Эндотермические реакции: ΔH > 0. В этом случае температурный коэффициент логарифма константы равновесия положителен; повышение температуры увеличивает величину константы равновесия (смещает равновесие вправо)
15) Факторы, влияющие на химическое равновесие.Принцип Ле-Шателье
Факторы, влияющие на химическое равновесие:
1) температура
При увеличении температуры химическое равновесие смещается в сторону эндотермической (поглощение) реакции, а при понижении - в сторону экзотермической (выделение) реакции.
2) давление
При увеличении давления химическое равновесие смещается в сторону меньшего объёма веществ, а при понижении - в сторону большего объёма. Этот принцип действует только на газы, т.е. если в реакции участвуют твердые вещества, то они в расчет не берутся.
3) концентрация исходных веществ и продуктов реакции
При увеличении концентрации одного из исходных веществ химическое равновесие смещается в сторону продуктов реакции, а при повышении концентрации продуктов реакции - в сторону исходных веществ.
|
из
5.00
|
Обсуждение в статье: Классификация термодинамических систем. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы


