 |
Главная |
Химическая коррозия стёкол в растворах реагентов
|
из
5.00
|
Первой группы
Реагенты первой группы вызывают удаление из поверхностного слоя щелочных компонентов путем гидролиза силикатов и последующего растворения гидроксидов. В общем случае протекает реакция:
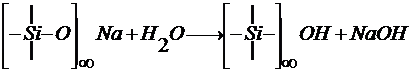 .
.
Растворимые гидроксиды диффундируют в раствор, труднорастворимые – остаются на поверхности. Поверхностный слой отличается повышенным содержанием диоксида кремния SiO2 и пронизан ультрадисперсными порами, заполненными продуктами гидролиза. При толщине поверхностного слоя δ > 50 нм скорость разрушения стекла замедляется.
При воздействие на стекло кислот (соляной, муравьиной, уксусной, азотной) в основном протекают те же процессы. При разбавлении кислот гидролиз усиливается, возрастает скорость перехода продуктов гидролиза в раствор. В результате образуется крупнопористый и толстый (δ ≈ 100 – 300 нм) защитный кремнезёмистый слой. Понижается химическая активность поверхности, электропроводность, коэффициент отражения. Тем не менее, прозрачность стекла остается высокой.
Подобным же образом действуют на стекло кислые газы, образующиеся сернокислотные или углекислотные соединения, которые легко смываются с поверхности. Если поверхность не омывается водой или раствором, то продукты реакции могут вызывать глубокие местные разрушения поверхности.
Особую осторожность следует проявлять при хранении листов стекла в ящиках, так как тонкие зазоры втягивают и удерживают влагу. Капли атмосферной влаги, растворяющие углекислый газ, при попадании между листами стекла вызывают интенсивную коррозию. Возникающий в ходе реакции щелочной раствор приводит к появлению изъянов в стекле.
По химической устойчивости к реагентам первой группы стёкла делятся на 5 гидролитических классов. Высокой химической устойчивостью обладает кварцевое стекло, боросиликатные стёкла (В2О3 < 17%), алюмосиликатные стёкла. Химическую устойчивость стекла повышают оксиды титана, циркония, ниобия, тантала, олова. Химическая устойчивость тем выше, чем ниже растворимость соответствующего гидрооксида.
В стёклах системы Ме2О–SiO2 коррозионная стойкость понижается от литиевых силикатов к калиевым. При наличии в стекле двух оксидов щелочных металлов (ΣМе2О > 10мол.%) химическая устойчивость на 30-50% выше, чем при эквивалентном содержании одного из оксидов. Это эффект «двух щелочей», он наблюдается при изучении и других свойств, например, электропроводности.
Щелочно-земельные силикаты МеО-SiO2 более химически устойчивы. Химическая устойчивость понижается в ряду: Be-Mg-Ca-Sr-Ba. Высокой химической стойкостью обладают цинкосодержащие стёкла. У свинецсодержащих стёкол низкая коррозионная стойкость. Катионы алюминия и бора повышают химическую стойкость, если встраиваются в кремнекислородную сетку.
Большинство промышленных стёкол относятся к III и IV гидролитическим классам. Более стойкими являются медицинское и химико-лабораторное стекла.
Защитные покрытия:прозрачные плёнки кремнийорганических соединений, фториды кадмия, оксиды алюминия и цинка. Для повышения химической стойкости стекла обрабатывают растворами кислот или выдерживают в атмосфере кислых газов.
Так как реагенты первой группы действуют на оксиды-модификаторы, расположенные в межтетраэдрических порах, то скорость коррозии замедляется со временем.
Воздействие на стекло реагентов второй группы.
Химическая полировка
Реагенты второй группы разрушают непосредственно кремнекислородный каркас. При этом полностью удаляются поверхностные слои стекла, скорость травления постоянна, толщина растворённого слоя пропорциональна времени действия раствора. Протекает следующая реакция:
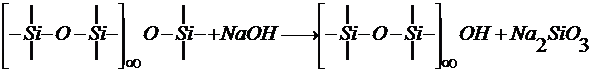
Образуются стабильные анионы типа 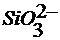 ,
, 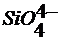 ,
, 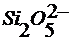 и соответствующие растворимые силикаты щелочных металлов.
и соответствующие растворимые силикаты щелочных металлов.
Действие растворов щелочей на стекло усиливается в ряду:
NH4OH – LiOH – NaOH – KOH.
Для основных гидрооксидов скорость растворения возрастает в ряду:
Ca(OH)2 – Sr(OH)2 – Ва(ОН)2.
Карбонаты соответствующих металлов действуют сильнее, чем щёлочи.
Na2CO3 действует сильнее, чем NaOH;
K2CO3 действует сильнее, чем KOH.
Устойчивость стекла к реагентам второй группы определяют по потери массы на 100 см2 поверхности образца при кипячении в 2Н растворе NaOH или в смеси 0,5Н раствора NaOH и 0,5Н раствора Na2CO3. Выделяют три класса стёкол (табл. 4.7).
Таблица 4.7
Классы устойчивости стёкол к реагентам второй группы
| Класс | |||
Δm, 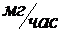
| 0–75 | 75–150 | >150 |
Состав стёкол мало влияет на щёлочеустойчивость. Однако в целом кварцевое стекло более устойчивое по сравнению с многокомпонентными стёклами. Повышают стойкость оксиды циркония, олова, лантана. Растворы фосфатов разрушают силикатное стекло значительно сильнее щелочей.
Химическая устойчивость силикатных стёкол к реагентам второй группы примерно в 100 раз ниже, чем к реагентам первой группы (1,5 мг и 150 мг – максимальные значения потери массы). Под действие реагентов второй группы поверхность стекла становится матовой, а прозрачность уменьшается.
Действие плавиковой кислоты сводится к реакции:
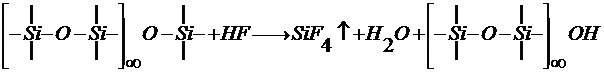
Сущность химической полировки основана на разрушающем действии на стекло плавиковой кислоты. В производстве сортовых хрустальных изделий химическая полировка применяется для полирования рисунков алмазной резьбы, имеющих после гранения шлифованный вид. Химическая полировка стекла протекает при взаимодействии стекла со смесью плавиковой и серной кислот, из которых преобладающее влияние имеет плавиковая кислота. Вступая в реакцию со стеклом, она образует газообразный фтористый кремний и фториды металлов по следующей схеме:
SiO2 + 4HF → SiF4↑ + 2H2O;
SiF4 + 2HF → H2SiF6.
При этом разрушается кремнекислородная основа стекла, и оксиды металлов, входящие в состав стекла, легче вступают в реакцию с образованной кремнефтористоводородной кислотой:
К2О + H2SiF6 → К2SiF6↓ + Н2О;
СаО + H2SiF6 → Са2SiF6↓ + Н2О.
При химической полировке за счёт протекания этих и других реакций наблюдается растворение микронеровностей стекла, что приводит к получению прозрачной, блестящей поверхности изделий.
При химическом матировании к смеси плавиковой и серной кислот добавляют вещества, которые ограничивают растворение образующихся на поверхности стекла при травлении малорастворимых фторидов и фторосиликатов. Для матирования применяют фтористые или сернокислые соли щелочных металлов. На практике лучше всего оправдали себя кислые фториды аммония и калия. Грубая матовость получается при добавлении соли аммония, тонкая матовость – соли натрия. Рекомендуется следующее соотношение компонентов (по массе): 2 HF: К2СО3:6Н2О.
4.9. Механические свойства стёкол
Упругость стекла
Упругостью называется свойство твердого тела восстанавливать свою первоначальную форму после прекращения действия силы. Модуль нормальной упругости Е (модуль Юнга) определяет величину напряжений при деформировании тела (растяжении, сжатии). Удлинение Δl стержня длиной l c поперечным сечением S прямо пропорционально нагрузке Р и обратно пропорционально модулю упругости (в пределах применимости закона Гука).
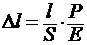 ;
; 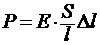 ;
; 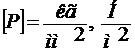 .
.
Чем выше модуль упругости, тем больше требуется нагрузка для достижения заданной деформации. Модуль сдвига G равен отношению касательного напряжения к углу сдвига и в пределах применимости закона Гука также является величиной постоянной. Модуль нормальной упругости Е связан с модулем сдвига G соотношением:
Е = 2G∙(1 + μ),
где μ – коэффициент Пуассона, равный отношению сужения стержня ΔS/S к его удлинению Δl/l.
Через Е и μ рассчитывается напряжение в двухслойных стеклах, спаях стекла с металлом, керамикой и другими материалами. Чем больше Е, тем меньше шансов у образца стекла выдержать деформацию при растяжении. Высокий модуль придает конструкции жесткость.
Внутреннее трение
Внутреннее трение определяет способность тела поглощать механические колебания. Затухание колебаний зависит от состава стекла, температуры, частоты колебаний, наличия напряжений и микронеоднородностей в стекле.
Внутреннее трение твердого силикатного стекла обусловлено собственными колебаниями Si–O каркаса и тех или иных структурных элементов и ионов между положениями равновесия.
Мерой внутреннего трения при низких частотах (0,1 – 100 гц) служит величина
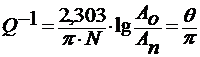 ,
,
где N – число колебаний маятника (нить из стекла) за время которых начальная амплитуда Ао уменьшается за амплитуды Аn. Параметр Ө - логарифмический декремент затухания колебаний.
В мегагерцевом диапазоне частот при длине волны λ о величине Q-1 судят по коэффициенту поглощения ультразвуковых волн α:
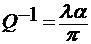 .
.
Внутреннее трение учитывается, прежде всего, при использовании стекла, как передающей упругой среды в ультразвуковой технике.
Прочность стекла.
Различают теоретическую и техническую прочность. Теоретическая прочность определяется прочностью связей между атомами в стекле. Техническая прочность лимитируется поверхностными и объемными дефектами стекла. Наибольшее влияние на техническую прочность оказывают поверхностные микротрещины. В зависимости от вида действующей нагрузки различают пределы прочности при растяжении, сжатии, изгибе, кручении, ударе.
Прочность при растяжении. Исходя из работы, которая необходима для образования двух новых поверхностей при появлении микротрещины, Орован получил для теоретической прочности следующее выражение:
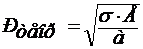 ,
,
где σ – поверхностное натяжение при комнатной температуре;
Е – модуль упругости;
а – расстояние между атомами.
Оценка значения Ртеор по этому уравнению для кварцевого стекла при а = 3,6 ∙ 10-10 м, σ = 500 мН/м, Е = 73200 МПа составляет примерно 10000 МПа. Для листового стекла Ртеор = 7200 МПа. Техническая прочность силикатных стекол составляет 30-120 МПа. Как видно, техническая прочность стекла примерно на 2 порядка величины меньше теоретической.
Такое большое различие между теоретической и практической прочностью стёкол, согласно теории Гриффитса, объясняется наличием на их поверхности и в объёме микротрещин, посторонних включений и других дефектов. Они имеются во всех стёклах и являются концентраторами напряжений.
Прочность стекла в сильной мере зависит от размера образца. Это видно из приведенных ниже данных для прочности нитей разного диаметра из кварцевого стекла (табл. 4.8).
Таблица 4.8
Изменение прочности стеклянной нити с её диаметром
| Диаметр нити, мкм | ||||||
| Прочность на разрыв, МПа |
Упрочнение стекловолокна с уменьшением диаметра нити связано с уменьшением площади поперечного сечения уравнением Вейбулла:
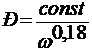 .
.
Эффект высокой прочности стеклянных волокон по сравнению с прочностью массивного образца обусловлен более изотропной структурой стекловолокна и высокой скоростью их охлаждения, что предотвращает образование опасных микродефектов и микротрещин на поверхности волокон в процессе их формирования.
Удельная прочность гораздо сильнее зависит от размеров сечения образца, состояния поверхности, режима термообработки, чем от состава. Например, прочность массивного кварцевого стекла на разрыв равна 8 кг/мм2 (1 кг/мм2 = 10 МПа), прочность свежетянутых нитей кварцевого стекла намного выше и возрастает с уменьшением диаметра. При диаметре 5-10 мкм прочность кварцевых нитей доходит до 590 кг/мм2, а после выдержке в жидком азоте – до 1800 кг/мм2.
Выдержка стекла при 100-150оС в течение часа заметно снижает прочность, что связано со скрытой кристаллизацией образцов. Начало кристаллизации нитей (волокон) сдвигается в сторону меньших температур.
Способы упрочнения листового стекла:
- травление в плавиковой кислоте;
- закалка в воздушном потоке;
- закалка в жидкости;
- закалка с последующим травлением.
Обычное листовое стекло имеет прочность на изгиб 6÷8 кг/мм2;
- после упрочнения – 50÷140 кг/мм2;
- в сухой атмосфере и при тщательном предохранении от случайных повреждений – 300 кг/мм2;
Трехстадийная обработка:
1. Жидкостная закалка в ультразвуковом поле;
2. Травление;
3. Нанесение защитных покрытий.
В результате обработки прочность возрастает до 350-450 кг/мм2;
Твёрдость стёкол
Твёрдость – это способность данного материала сопротивляться проникновению в него другого тела. В зависимости от способа проникновения различают прочность на вдавливание, абразивную твердость и др. Каждый из видов твёрдости может измеряться различными методами, причем значения твёрдости зависят от методов измерения.
Обычно измеряют микротвёрдость стекол. О микротвёрдости судят по размерам отпечатка, получаемого при вдавливании в стекло квадратной алмазной пирамидки с углом между гранями 136о под нагрузкой до 200г.
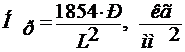 ,
,
Р – нагрузка в граммах;
L – длина диагонали отпечатка в микронах.
Твёрдость является сложной функцией от состава и не может быть рассчитана с помощью общих для различных стёкол коэффициентов и уравнений. Рассчитанная по приведённому уравнению микротвёрдость зависит также и от времени выдержки при вдавливании.
Хрупкость стёкол
Стекло – типично хрупкое тело. Хрупкость – свойство материала разрушаться без заметной пластической деформации. Пластичность и эластичность – свойства, противоположные хрупкости. Пластичность – способность к большим необратимым деформациям. Эластичность – способность к большим обратимым деформациям.
Хрупкие тела неспособны значительно деформироваться как обратимо, так и необратимо. О хрупкости судят по ударной вязкости при изгибе. Удельная ударная вязкость αн равна работе ударного излома, отнесенная к поперечному сечению образца. Величина αн для стекол равна всего лишь 0,01–0,02 кгм/см2, тогда как для сталей в сотни раз выше (2–25 кгм/см2). Микрохрупкость определяется вместе с микротвердостью.
БИБЛИОГРАФИЧЕСКИЙ СПИСОК
1. Гулоян Ю.А. Физико-химические основы технологии стекла. Владимир: «Транзит-ИКС», 2008. – 736 с.
2. Гулоян Ю.А. Технология стекла и стеклоизделий. Владимир: Транзит-Икс, 2003. – 480 с.
3. Горшков В.С., Савельев В.Г., Фёдоров Н.Ф. Физическая химия силикатов и других силикатных соединений. М.: Высшая школа, 1988. – 400 с.
4. «Химическая технология стекла и ситаллов», Под редакцией Н. М. Павлушкина. - М.: Стройиздат, 1983. – 432 с.
5. Шульц М. М., Мазурин О. В. «Современные представления о строении стекол и их свойствах», Ленинград: Наука, 1988. – 197 с.
6. Странд З. «Стеклометаллические материалы», Москва: Стройиздат, 1988. – 254 с.
7. Петсольд А., Пешманн Г. «Эмаль и эмалирование», М.: Металлургия, 1990. – 572 с.
8. Аппен А. А. «Химия стекла», Л.: Химия, 1970. – 351 с.
9. Матвеев М. А., Матвеев Г. Н., Френкель Б. Н. «Расчеты по химии и технологии стекла», М.: Издательство литературы по строительству, 1972. – 240 с.
10. Герасимов В.В. Неорганические полимерные материалы на основе оксидов кремния и фосфора /Казанский инженерно-строительный институт, М., Стройиздат, 1993. – 296 с.
|
из
5.00
|
Обсуждение в статье: Химическая коррозия стёкол в растворах реагентов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

