 |
Главная |
Цель и задачи дисциплины
|
из
5.00
|
ТЕПЛОТЕХНИКА
Программа, методические указания и
контрольные задания
Составители: Н.А. Цветков, Ю.И. Чижик
Томск – 2005
Теплотехника. Программа, методические указания и задание по курсовой работе по курсу «Теплотехника». /Составители:
Н.А. Цветков, Ю.И. Чижик Томск. Изд-во Томского государственного архитектурно-строительного университета. 2004. – 64 с.
Рецензент: А.Н. Хуторной
Редактор Т.С. Володина
Программа, методические указания и задание к курсовой работе по курсу «Теплотехника» предназначены для студентов заочной формы обучения специальности 150200 «Автомобили и автомобильное хозяйство».
Печатается по решению методического семинара кафедры «Теплогазоснабжение» № 1 от 28 января 2005 г.
Утверждены и введены в действие проректором по учебной работе О.Г. Кумпяком
с 01.02.2005 г.
до 01.02.2010 г.
Изд. лиц. 021253 от 31.10.97. Подписано в печать 2005 г. Формат 60´90/16. Бумага офсет. Гарнитура Таймс, печать
офсет. Уч.-изд. л. 3,3. тираж 100 экз.
Заказ №
Изд-во ТГАСУ, 634003, г. Томск, пл. Соляная, 2
Отпечатано с оригинал-макета в ООП ТГАСУ.
634003, г. Томск, ул. Партизанская, 15. 
 ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
ОБЩИЕ МЕТОДИЧЕСКИЕ УКАЗАНИЯ
Студент-заочник, руководствуясь программой курса и методическими указаниями к ней, самостоятельно изучает материал учебника и учебных пособий и выполняет курсовую работу. Со всеми непонятными вопросами нужно обращаться за консультацией на кафедру «Теплогазоснабжение». В период экзаменационной сессии по наиболее сложным вопросам преподаватели читают лекции.
Курс теплотехники рекомендуется изучать в последовательности, указанной в программе и методических указаниях. Необходимо разобраться в основных понятиях и определениях, которые, как правило, предшествуют выводу определенной формулы. Надо понять ход математических выводов, а затем самостоятельно, не заглядывая в учебник, вывести соответствующую формулу. Следует иметь в виду, что математические приемы, применяемые в курсе, должны помогать глубокому пониманию разбираемых явлений и процессов, но ни коем случаем не заслонять собой их физической сущности.
При изучении теоретического курса, как и при решении задач, необходимо обращать внимание на единицы величин, с которыми проводятся математические операции. Следует помнить, что проверка единиц в процессе математических выкладок помогает выявить ошибки, допущенные в ходе математических операций. Надо учитывать, что единица всякой величины, как правило, отражает ее физический смысл.
После изучения теоретического материала темы, необходимо разобраться с методикой решения задач ,приведенных в учебнике и задачниках.
Умение решать задачи является критерием усвоения данной темы.
Для лучшего усвоения материала курса рекомендуется составлять конспект по каждой теме. Конспект может составляться либо при первоначальном изучении учебника, либо после решения задач и ответов на вопросы для самопроверки. В последнем случае при работе над составлением конспекта желательно обходиться без учебника.
ЛИТЕРАТУРА
Основная
1 Луканин В.Н., Шатров.М.Г, и дрТеплотехника .М.1999.,671стр
2 Нащокин В.В. Техническая термодинамика и теплопередача. М.: Высшая школа, 1980.-550с
3 Щукин А.А., Сушкин И.Н.,Бахмачевский В.И., ЛызоГ.П. Теплотехника. М., 1973
4 Баскаков А.П. Теплотехника. М.: Энергоатомиздат, 1988.- 420 с.
5 Хазен М.М., Матвеев Г.А. и др. Теплотехника. М.,1981.-300с.
6 Дрыжаков Е.В. и др./ Под ред. В.Н.Крутого / Техническая термодинамика. М.: 1981. - 439с.
7 Болгарский А.В.,Мухачев Г.А.,Щукин В.К. Термодинамика и теплопередача. М.; Высшая школа, 1975. - 495с.
8 Михеев М.А., Михеева И.М. Основы теплопередачи. М.: Энергия.1977. - 344с.
9 Сборник задач по технической термодинамике и теплопередаче/ Под ред. Б.Н.Юдаева . М.: Высшая школа. 1968. -373с.
10 Андрианова и др. Сборник задач по технической термодинамике. М.: Энергоиздат. 1981. - 240с.
Дополнительная литература
2.1. Кириллин В.А.,Шейдлин А.Е.,Сычев В.В. Техническая термодинамика. М.: Наука. 1974. - 512с.
2.2. Арнольд Л.В.,Михайловский Г.А.,Селиверстов В.М. Техническая термодинамика и теплопередача. М. : Высшая школа. 1979. -446с.
.2.3. Недужий И.А., Алабовский А.К. Техническая термодинамика и теплопередача. Киев. : Наукова думка. 1980.-302с.
.2.4. Железко Б.Е. и др. Термодинамика и двигатели внутреннего сгорания. М.: Высшая школа. 1985. -271с.
2.5. Болгарский А.В. Сборник задач по термодинамике и теплопередаче. М.: Высшая школа. 1972. -304с.
2.6. Краснощеков Е.А., Сукомел А.С. Задачник по теплопередаче. М.: Энергия. 1980. - 288с.
ПРОГРАММА ДИСЦИПЛИНЫ
Цель и задачи дисциплины
Целью преподавания дисциплины «Теплотехника» является теоретическая и практическая подготовка будущих инженеров-механиков по методам получения, преобразования, передачи и использования теплоты в такой степени, чтобы они могли выбирать и при необходимости эксплуатировать теплотехническое оборудование, задействованное в основных технологических процессах, при максимальной экономии топливных ресурсов.
Задачами данной дисциплины в соответствии с требованиями государственного образовательного стандарта является формирование у студентов:
-знаний теплотехнической терминологии, законов термодинамики, методов и принципов термодинамического анализа теплоэнергетических устройств и тепловых двигателей:
-знаний основ тепломассообмена, принципов теплоснабжения, методов учета и контроля расхода тепловой энергии применительно к транспортной энергетике, схем теплообеспечения транспортных предприятий;
-умений экспериментального определения основных эксплуатационных характеристик оборудования, средства транспорта.
Программа дисциплины "Теплотехника" построена на базе теоретических дисциплин: механики жидкости и газа, физики и математики.
1.2.Основное содержание дисциплины
Введение
Предмет курса, место и роль подготовки инженеров-механиков. Связь теплотехники с другими отраслями знаний.
Основные исторические этапы становления теплотехники, роль теплотехники в научно-техническом прогрессе. Проблемы экономии топливно-энергетических ресурсов, снижение норм расхода теплоты и топлива, защита окружающей среды. Основные задачи курса.
Основные понятия и определения термодинамики
Предмет технической термодинамики и ее методы. Термодинамическая система. Основные параметры состояния. Равновесное и неравновесное состояние. Уравнение состояния для идеального газа. Теплота и работа как формы передачи энергии. Термодинамический процесс. Равновесный и неравновесный, обратимый и необратимый процессы. Круговые процессы (циклы). Теплоемкость. Массовая, объемная и молярная теплоемкости. Теплоемкость истинная и средняя, при постоянном давлении и постоянном объеме. Связь между теплоемкостями для идеального газа. Газовые смеси. Способы задания газовой смеси. Соотношения между объемными и массовыми долями. Кажущаяся молекулярная масса и газовая, постоянная смеси.
Методические указания
Техническая термодинамика – наука, изучающая взаимопревращения теплоты, работы и условия при которых эти превращения совершаются наиболее эффективно. Она устанавливает взаимосвязь между тепловыми и механическими процессами, которые совершаются в тепловых и холодильных машинах, изучает процессы, происходящие в газах и парах, а также свойства этих тел при различных физических условиях.
Студент должен усвоить, что теоретическим фундаментом, на котором базируются все выводы технической термодинамики, является первый и второй законы термодинамики, представляющие собой обобщение опыта познания человеком природы. Основная особенность метода термодинамики - логически последовательное применение аналитических выражений первого и второго законов термодинамики совместно с уравнением состояния рабочего тела, без использования каких-либо гипотез о внутреннем его строении. Этот метод оказывается эффективным как при теоретических выводах формул, так и при анализе работы различных тепловых и холодильных машин и установок. При изучении темы студент должен внимательно разобрать такие понятия, как термодинамическая система, рабочее тело и внешняя среда, равновесное и неравновесное состояние рабочего тела, термодинамический процесс
Необходимо усвоить определения и физическую суть таких понятий, как равновесный и неравновесный, обратимый и необратимый термодинамический процесс. Понять, что равновесное состояние рабочего тела, так же как равновесный и обратимый процессы, является научной абстракцией, как некоторые идеализированные модели реальных состояний и процессов. Реальные состояния и процессы приближаются к идеализированным при условии очень малых изменений параметров состояния и когда время между последовательными измерениями состояния достаточно велико. Однако, именно введение этих идеализированных понятий позволило построить стройный математический аппарат термодинамики, позволяющий получать результаты, достаточно близкие к практике.
Для усвоения последующего материала необходимо уяснить, что теплота и работа представляют собой определенные формы передачи энергии – тепловую и механическую, причем работа может переходить в теплоту, а теплота в работу, т. е. они взаимопревращаемы.
Работа всегда полностью превращается в теплоту, в то время как переход теплоты в работу имеет определенные ограничения даже в идеальном процессе. Это обстоятельство подробно изучается в теме 3, посвященной второму закону термодинамики. Взаимное превращение теплоты и работы в тепловой машине осу -ществляется с помощью рабочего тела, которое благодаря тепловому и механическому воздействию должно обладать способностью значительно изменять свой объем. Поэтому в качестве рабочего тела в тепловых машинах используется газ или пар. Усвоить, что физическое состояние рабочего тела в термодинамике определяется тремя параметрами: абсолютным давлением - p, удельным объемом- v и абсолютной температурой - T. Эти три параметра называются основными и связаны между собой уравнением состояния F (p.v.T) = 0.Независимые, т. е. выбираемые произвольно, - два любых параметра, а третий определяют из уравнения состояния. Например, если p и v – независимые параметры, то T=j (p.v),где j(p.v) –функция, определяемая при решении уравнения состояния относительно зависимого параметра T.
Для четкого понимания физической сути изучаемых закономерностей термодинамики и принципов работы различных теплотехнических устройств нужно овладеть принципом графического изображения любых процессов, включая круговые (циклы) в термодинамических диаграммах. Необходимо уяснить, что графически можно изображать только равновесные, обратимые процессы и циклы, которые совершаются рабочим телом. Во всех теплотехнических установках, в которых в качестве рабочего тела используют газ, он считается идеальным, т. е. Газом, состоящим из молекул – материальных точек, не имеющих размеров и между которыми отсутствуют силы взаимодействия (притяжения и отталкивания), кроме упругих соударений. Как известно из физики, такой газ подчиняется уравнению состояния Клапейрона, которое может быть записано для m кг газа (PV = mRT)и для 1 кг газа (pv = RT, где v = V/m –удельный объем газа, м 3 /кг)
Понятие идеального газа является научной абстракцией, моделью реального газа, дающей хорошую сходимость с практикой, когда состояние газа далеко от состояния сжижения. Применение этой модели позволяет построить достаточно простые аналитические зависимости термодинамики, применение которых к тепловым машинам дает, как правило, приемлемую сходимость с практикой. Для насыщенного пара, т е. для состояния, близкого к состоянию сжижения, модель идеального газа неприемлема. В этом случае приходится применять очень сложные модели и уравнения реальных газов, в которых учитывают собственные размеры молекул, а также силы взаимодействия между ними. Разобрать полученное уравнение состояния Клайперона-Менделеева для 1 моля идеального газа. Важно понять различие между удельной газовой постоянной, принимающей определенное значение для каждого газа, и универсальной газовой постоянной, одинаковой для всех газов и равной R 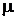 =8,314 кДж/(кмоль×K). Следует запомнить связь между этими газовыми постоянными и понять физический смысл каждой из них. При изучении газовой смеси необходимо понять, что основным здесь является умение определять газовую постоянную смеси, заданной массовым и объемным составом. Знание газовой постоянной смеси позволяет при исследовании термодинамических процессов пользоваться уравнением Клайперона так же, как и для отдельного газа.
=8,314 кДж/(кмоль×K). Следует запомнить связь между этими газовыми постоянными и понять физический смысл каждой из них. При изучении газовой смеси необходимо понять, что основным здесь является умение определять газовую постоянную смеси, заданной массовым и объемным составом. Знание газовой постоянной смеси позволяет при исследовании термодинамических процессов пользоваться уравнением Клайперона так же, как и для отдельного газа.
В этой теме раскрывается необходимый комплекс определений и понятий, на основе которых строится все дальнейшее изложение технической термодинамики.
Литература:[2], с. 5-20, 22-26,28-32,54-56.
Законы термодинамики
Работа и техническая работа термодинамического процесса и изображение работ в pv- диаграмме. Внутренняя энергия и энтальпия. Сущность первого закона термодинамики. Формулировка и математическая запись закона. Энтропия. Сущность второго закона термодинамики. Основные формулировки второго  закона. Цикл Карно, цикл теплового двигателя и холодильной машины. Термодинамический коэффициент полезного действия цикла, Аналитическое выражение второго закона для обратимых и необратимых процессов. Изменение энтропии в процессах. Тs- диаграмма и ее свойства. Эксергия. Эксергия рабочего тела и теплоты
закона. Цикл Карно, цикл теплового двигателя и холодильной машины. Термодинамический коэффициент полезного действия цикла, Аналитическое выражение второго закона для обратимых и необратимых процессов. Изменение энтропии в процессах. Тs- диаграмма и ее свойства. Эксергия. Эксергия рабочего тела и теплоты
Методические указания
Студент должен понять особенности применения в термодинамике общего закона сохранения и превращения энергии. Энергетические изменения, происходящие в термодинамической системе, определяют по изменению параметров рабочего тела, которое является объектом анализа.
Аналитическое выражение первого закона термодинамики имеет две формы:
 и
и  .
.
Следует четко разобраться в разнице понятий "работа расширения" и "располагаемая работа" и уметь дать геометрическую интерпретацию их в pv диаграмме. Уяснить принципиальную разницу между внутренней энергией, однозначно определяемой данным состоянием рабочего тела, а также работой и теплотой, которые появляются лишь при наличии процесса перехода рабочего тела из одного состояния в другое и, следовательно, зависят от характера этого процесса. Следует понять разницу между функцией состояния и функцией процесса. При изучении темы вводиться еще одна функция (параметр) состояния, которая называется энтропией. Здесь этот параметр служит лишь для упрощения термодинамических расчетов, а главное позволяет графически изобразить теплоту, участвующую в процессе, в диаграмме Ts. Нужно понять, как из выражения ds = dq/Tможно установить знак теплоты, участвующей в процессе. Знание этого вопроса поможет при использовании TS- Диаграммой, в которой теплота q=  Tds изображается. в масштабе площадью под кривой процесса. В диаграмме Ts определяет в масштабе количества теплоты, подведенной к рабочему телу (+) (ds>0) или отведенной от него (-) (ds<0).
Tds изображается. в масштабе площадью под кривой процесса. В диаграмме Ts определяет в масштабе количества теплоты, подведенной к рабочему телу (+) (ds>0) или отведенной от него (-) (ds<0).
Непрерывное получение работы за счет подведения теплоты возможно только в цикле и невозможно в разомкнутом процессе. Поэтому следует тщательно изучить все вопросу, относящиеся к циклам, особенно к циклу Карно, который имеет большое значение в термодинамике. С его помощью выводят все аналитические зависимости, относящиеся ко второму закону термодинамики, а формула для к. п. д. этого цикла, по существу, является техническим выражением существа второго закона термодинамики в применении к тепловым машинам.
Обратимый цикл Карно при выбранных температурах Тmax горячего источника теплоты и Тmin холодильника имеет наивысший термический к. п. д. среди любых других обратимых циклов. Первый закон термодинамики не устанавливает условий, при которых теплота в машине превращается в работу. Это легко уяснить из следующих рассуждений. Если применить уравнение первого закона термодинамики к циклу и проинтегрировать его по замкнутому контуру цикла, то получим :
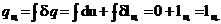
поскольку u-функция состояния. Отсюда вытекает, что теплота, подведенная к рабочему телу в цикле (q  ), равна работе, полученной в результате совершения цикла (l
), равна работе, полученной в результате совершения цикла (l  ). Последнее может привести к неверному выводу о полном превращении теплоты в работу цикла, что равносильно возможности создания вечного двига
). Последнее может привести к неверному выводу о полном превращении теплоты в работу цикла, что равносильно возможности создания вечного двига  теля второго рода. Это противоречие легко устранить с помощью понятия энтропии, как функции состояния. Проинтегрировав выражение
теля второго рода. Это противоречие легко устранить с помощью понятия энтропии, как функции состояния. Проинтегрировав выражение  по замкнутому контуру цикла, получим
по замкнутому контуру цикла, получим  так как s-функция состояния. Учитывая, что абсолютная температура Т не может быть величиной отрицательной, приходим к выводу, что интеграл
так как s-функция состояния. Учитывая, что абсолютная температура Т не может быть величиной отрицательной, приходим к выводу, что интеграл  может быть равен нулю только в том случае, если на отдельных участках цикла будет иметь место неравенство
может быть равен нулю только в том случае, если на отдельных участках цикла будет иметь место неравенство  , т. е. будет осуществляться отвод теплоты. Следовательно, при совершении цикла наряду с подводом теплоты к рабочему телу
, т. е. будет осуществляться отвод теплоты. Следовательно, при совершении цикла наряду с подводом теплоты к рабочему телу  обязательно должны быть процессы с отводом теплоты
обязательно должны быть процессы с отводом теплоты  . Именно это и означает, что подведенную к рабочему телу теплоту в цикле нельзя полностью превратить в работу. Несмотря на наличие в литературе большого количества формулировок закона термодинамики, сущность этого закона сводиться к двум положениям: 1) теплота не может самопроизвольно переходить от холодного тела горячему без затраты работы. 2) для превращения теплоты в работу в периодически действующей машине необходимо наличие не менее двух источников теплоты: теплоотдатчика (горячего) и теплоприемника (холодного). При этом только часть теплоты, переданной телу от горячего источника, может быть превращена в работу, остальная часть должна быть отдана холодному источнику. В отличие от первого закона термодинамики, являющегося абсолютным законом природы, справедливым как для макромира, второй закон термодинамики таковым не является. Объясняется это тем, что он получен из наблюдений над объектами, имеющими конечные размеры в окружающих нас земных условиях, и не может произвольно распространяться как на бесконечную Вселенную, так и на бесконечный микромир. Следует иметь в виду, что если рассматривается изолированная система, состоящая из теплоотдатчика, рабочего тела, совершающего обратимый цикл Карно, и теплоприемника, то: а) в случае обратимых процессов передачи теплоты (т. е. при бесконечно малой разнице температур) от энтропия рабочего тела в цикле (как функция состояния) всегда остается неизменной(
. Именно это и означает, что подведенную к рабочему телу теплоту в цикле нельзя полностью превратить в работу. Несмотря на наличие в литературе большого количества формулировок закона термодинамики, сущность этого закона сводиться к двум положениям: 1) теплота не может самопроизвольно переходить от холодного тела горячему без затраты работы. 2) для превращения теплоты в работу в периодически действующей машине необходимо наличие не менее двух источников теплоты: теплоотдатчика (горячего) и теплоприемника (холодного). При этом только часть теплоты, переданной телу от горячего источника, может быть превращена в работу, остальная часть должна быть отдана холодному источнику. В отличие от первого закона термодинамики, являющегося абсолютным законом природы, справедливым как для макромира, второй закон термодинамики таковым не является. Объясняется это тем, что он получен из наблюдений над объектами, имеющими конечные размеры в окружающих нас земных условиях, и не может произвольно распространяться как на бесконечную Вселенную, так и на бесконечный микромир. Следует иметь в виду, что если рассматривается изолированная система, состоящая из теплоотдатчика, рабочего тела, совершающего обратимый цикл Карно, и теплоприемника, то: а) в случае обратимых процессов передачи теплоты (т. е. при бесконечно малой разнице температур) от энтропия рабочего тела в цикле (как функция состояния) всегда остается неизменной(  ). Все реальные процессы являются необратимыми, поэтому энтропия изолированной системы, в которой протекают теплоотдатчика рабочему телу и от него теплоприемнику энтропия системы остается постоянной
). Все реальные процессы являются необратимыми, поэтому энтропия изолированной системы, в которой протекают теплоотдатчика рабочему телу и от него теплоприемнику энтропия системы остается постоянной 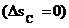 в случае если один из процессов, например теплоотдача от источника к рабочему телу, протекает при конечной разнице температур, энтропия системы возрастает (
в случае если один из процессов, например теплоотдача от источника к рабочему телу, протекает при конечной разнице температур, энтропия системы возрастает (  ). Независимо от обратимости процесса такие процессы, всегда возрастает(
). Независимо от обратимости процесса такие процессы, всегда возрастает(  ).Возрастание энтропии в необратимых процессах само по себе ни о чем не говорит. Однако возрастание энтропии (
).Возрастание энтропии в необратимых процессах само по себе ни о чем не говорит. Однако возрастание энтропии (  ) приводит к уменьшению работоспособности изолированной системы. Необходимо разобраться в том, что для количественной оценки потери работоспособности системы вводиться понятие удельной энергии, под которой понимают максимальную удельную работу, совершаемую системой при ее переходе от данного состояния до равновесия с окружающей средой. Следует понимать, почему потеря энергии, ведущая к уменьшению работоспособности системы из-за необратимости процесса, определяется произведением наименьшей температуры системы на приращение энтропии.
) приводит к уменьшению работоспособности изолированной системы. Необходимо разобраться в том, что для количественной оценки потери работоспособности системы вводиться понятие удельной энергии, под которой понимают максимальную удельную работу, совершаемую системой при ее переходе от данного состояния до равновесия с окружающей средой. Следует понимать, почему потеря энергии, ведущая к уменьшению работоспособности системы из-за необратимости процесса, определяется произведением наименьшей температуры системы на приращение энтропии.
Литература: [2], с.45-78, 96-123.
|
из
5.00
|
Обсуждение в статье: Цель и задачи дисциплины |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

