 |
Главная |
Равновесные и неравновесные процессы.
|
из
5.00
|
Термодинамическая система- совокупность макроскопических тел, которые обмениваются энергией, как между собой, так и с внешним телами(внешней средой).
Одно макроскопическое тело это уже термодинамическая система.
Статический и термодинамический метод(смотреть в 1ом билете)
Равновесные процессы –процесс при которых скоростью изменения термодинамических параметров бесконечно мала, т.е. изменение термод-их параметров происходит за бесконечно большие времена.
Равновесные процессы –процесс, который проходит через последовательность равновесных сотояний.
 Любое равновесное состояние
Любое равновесное состояние
может быть изображено точкой.
Следовательно, любой равновесный процесс можно изобразить
графически.
Неравновесный процесс –процесс, при которомизменение термодинамических параметров на конечную величину происходит за конечное время.
Идеальный газ. Законы идеального газа.
1.Собственны объем молекул газа пренебрежимо мал по сравнению с объемом пренебрежимо мал по сравнению с объемом сосуда. à Молекула – материальная точка.
2. Между молекулами газа отсутствуют силы взаимодействия.
3.Столкновения молекул газа между собой и со стенками сосуда абсолютно упругие. Следовательно идеальный газ – система независимых материальных точек.
Законы идеального газа
1. Законы Бойля Мариотта.
 pV =const
pV =const
Изотерма
m=const, t=const
Изотермический
Процесс.
2. Закон Гей - Люсака

 =const
=const
m=const, p=const
Изобарный процесс

 =0
=0

3. Закон Шарля.

 =const
=const
m=const, V=const
Изохорный процесс
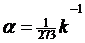

 =0
=0
4. 
 =const, при m=const
=const, при m=const
5. Закон Авогадро- моли любых газов при одинаковой температуре и давлении занимают одинаковые объемы.
При нормальных условиях
( 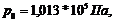
 )
)
он равен 
6. Закон Дальтона:  давление смеси идеальных газов равно сумме парциальных давлений входяших в неё газов.
давление смеси идеальных газов равно сумме парциальных давлений входяших в неё газов.
Парциальное давление - давлении, которое занимал бы газ, входящий в состав газовой смеси, если бы он один один занимал весь объем, в котором находится смесь.
Уравнение Клаперна -Менделеева- уравнение состояния газа для газа массы m
 (1)
(1)

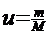 -кол-во вещ-ва
-кол-во вещ-ва
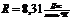 - молярная универсальная газовая
- молярная универсальная газовая
постоянная константа
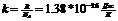 -
-
-постоянная Больцмана
Запишем уравнение (1) для 1 моля газа:

 -концентрация мол.
-концентрация мол.

p-плотность вещ-ва:
Поток молекул. Основное уравнение молекулярно-кинетической теории
См билет номер 4
Следствия из основного уравнения.
Смотри билет номер 5
|
из
5.00
|
Обсуждение в статье: Равновесные и неравновесные процессы. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

