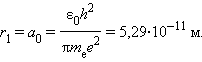|
Главная |
Атом водорода. Линейчатые спектры
|
из
5.00
|
Рассмотрим простейший атом – атом водорода. Он состоит из ядра, в состав которого входит один протон, и одного электрона, вращающегося вокруг ядра по круговой орбите. На электрон со стороны ядра действует кулоновская сила притяжения, сообщающая ему центростремительное ускорение, поэтому
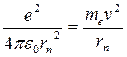
Скорость электрона, вращающегося по круговой орбите некоторого радиуса r в кулоновском поле ядра, как следует из второго закона Ньютона, определяется соотношением
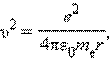
|
где e – элементарный заряд, ε0 – электрическая постоянная. Скорость электрона υ и радиус стационарной орбиты rn связаны правилом квантования Бора. Отсюда следует, что радиусы стационарных круговых орбит определяются выражением
|
Самой близкой к ядру орбите соответствует значение n = 1. Радиус первой орбиты, который называется боровским радиусом, равен
|
Радиусы последующих орбит возрастают пропорционально n2.
Полная механическая энергия E системы из атомного ядра и электрона, обращающегося по стационарной круговой орбите радиусом rn, равна
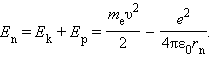
|
Следует отметить, что Ep < 0, так как между электроном и ядром действуют силы притяжения. Подставляя в эту формулу выражения для υ2 и rn, получим:
Еn = 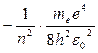
Целое число n = 1, 2, 3, ... называется в квантовой физике атома главным квантовым числом.
Уровень энергии, соответствующий минимальному значению энергии Е1 = -13,55 эВ (n = 1), называют основным, все остальные – возбужденными. При n = ∞ энергия максимальна, т.е. Е∞ = 0. Следовательно, значение Е∞ = 0 соответствует ионизации атома (отрыву от него электрона).
Исследования спектров излучения отдельных атомов показали, что каждому газу присущ определенный линейчатый спектр, состоящий из отдельных спектральных линий или групп близко расположенных линий В 1885 г. И. Бальмер показал, что 4 видимые линии в спектре водорода следуют формуле:
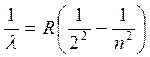
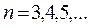 – энергетический уровень с которого переходит электрон в атоме; R = 1,097·107 м-1 – постоянная Ридберга
– энергетический уровень с которого переходит электрон в атоме; R = 1,097·107 м-1 – постоянная Ридберга
Совокупность спектральных линий атома водорода в видимой части спектра была названа серией Бальмера. С увеличением n линии серии сближаются, значение n = ∞ определяет границу серии. Позже аналогичные серии спектральных линий были обнаружены в ультрафиолетовой и инфракрасной частях спектра.
серия Лаймана 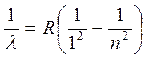
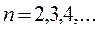 в ультрафиолетовой области
в ультрафиолетовой области
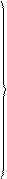 серия Пашена
серия Пашена 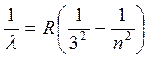

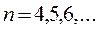
серия Брэккета 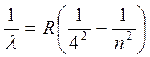
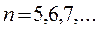 в инфракрасной области
в инфракрасной области
серия Пфунда 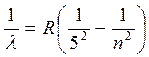
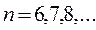
серия Хэмфри 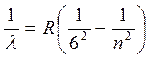
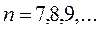
Все эти серии могут быть описаны одной формулой, которая называется обобщенной формулой Бальмера:
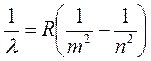
где m = – определяет серию;
n – определяет отдельные линии серии (n = m+1).
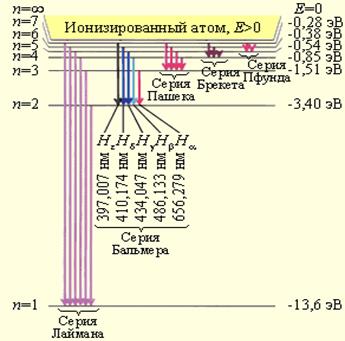
На рис. 3 изображена диаграмма энергетических уровней атома водорода и указаны переходы, соответствующие различным спектральным сериям.
|
| Рис. 3. Диаграмма энергетических уровней атома водорода. Показаны переходы, соответствующие различным спектральным сериям. Для первых пяти линий серии Бальмера в видимой части спектра указаны длины волн. |
Таким образом, постулаты Бора позволили полностью объяснить спектр водорода. Однако, попытки объяснить спектры других атомов привели к неудаче. Теория Бора была гениальной догадкой, но полная теория строения электронной оболочки была создана позже на основе квантовой механики, куда вошел второй постулат.
|
из
5.00
|
Обсуждение в статье: Атом водорода. Линейчатые спектры |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы