 |
Главная |
Теории кислотно-основных индикаторов
|
из
5.00
|
Кроме использования органических соединений для образования металлокомплексов, образования окрашенных соединений органические реагенты используются очень широко в аналитической химии в качестве индикаторов методов кислотно-основного титрования. Индикатор – это вещество, которое проявляет видимое изменение в точке эквивалентности или вблизи её. Кислотно-основные индикаторы в кислых и щелочных растворах имеют различную окраску. Иак, лакмус в кислой среде (рН < 7) окрашен в красный цвет, а в щёлочной (рН>7) – в синий; фенолфталеин в кислой – бесцветен, в щелочной – имеет красную или малиновую окраску.
Для объяснения природы изменения окраски индикаторов было предложено несколько теорий. Ионная теория кислотно-основных индикаторов предполагает наличие в растворе двух форм молекулы индикатора – кислой формы, имеющей один цвет, и основной формы, имеющей другой цвет. В зависимости от рН раствора и соответственно от преобладания той или иной формы, происходит окрашивание раствора в соответствующий форме молекулы индикатора цвет.
Хромофорная теория кислотно-основных индикаторов объясняет наличие окраски индикаторов, являющихся органическими соединениями, присутствием в молекулах индикаторов хромофорных групп. В роли хромофорных групп могут выступать такие группировки атомов и связей, как
–N=N–, =C=S=,-N=O,-N=N-
↓
O
хиноидные структуры и некоторые другие.
Далее предполагается, что индикаторы в растворе могут присутствовать в разных таутомерных формах, находящихся в равновесии. В кислой среде доминирует одна таутомерная форма индикатора с какой-то, а в щелочной – другая таутомерная форма с иной хромофорной группой. Примером сказанного может послужить индикатор фенолфталеин, который в кислой среде бесцветен, а в щелочной окрашен в красный цвет. Согласно хромофорной теории предполагается, что в водном растворе фенолфталеина устанавливается равновесие:
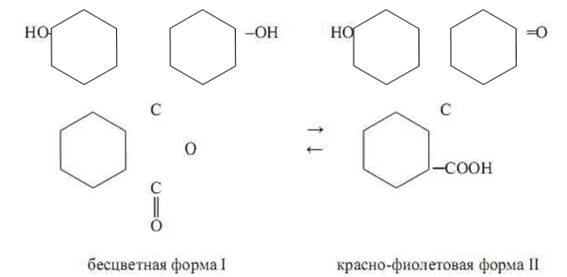
Таутомерная форма I не имеет хромофорной группы и поэтому бесцветна, а форма II обладает хиноидным хромофором и поэтому окрашена в красный цвет. Другой пример виден у индикатора метиловый оранжевый, который является натриевой солью диметиламиноазобензол-сульфокислоты (CH3 ) 2 N – C6H4– N=N – C6H4 – SO3Na. В водном растворе анион этой кислоты присоединяет протон и переходит в кислоту, которая подвергается превращению по схеме:
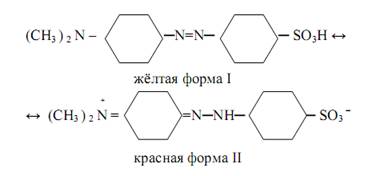
Таутомерная форма I имеет хромофор ─N=N─, придающий индикатору жёлтый цвет, а таутомерная форма II имеет другую хромофорную группу, придающую индикатору красный цвет.
Ионно-хромофорная теория, которая объединила представление ионной и хромофорной теорий.
В рамках этой теории принимается, что кислотно-основные индикаторы представляют собой слабые кислоты и основания, причём нейтральная молекула индикатора и её ионизированная форма содержат разные хромофорные группы.
Допустим, индикатор представляет собой слабую одноосновную кислоту HInd. В соответствии с ионно-хромофорной теорией в водном растворе индикатора устанавливается равновесии:
HInd = H+ + Indˉ = H+ + IndˉB
кислая форма I основная форма II
Кислая форма представляет собой нейтральную молекулу слабой кислоты HInd в какой-то таутомерной форме, основная форма IndˉB – это анион кислотной формы, которая является слабой кислотой в другой таутомерной форме. Хромофорные группы обеих таутомерных форм HInd и IndˉB неодинаковы, поэтому и окраска этих двух форм различна.
При изменении рН растворов, а именно при подкислении равновесие смещается влево – в сторону кислой формы и после понижения рН до такого значения рН1, когда в растворе доминирует эта форма, раствор принимает окраску формы I. При уменьшении концентрации ионов водорода равновесие смещается вправо – в сторону основной формы II. В случае индикатора фенолфталеина схему можно упрощённо представить следующим образом:
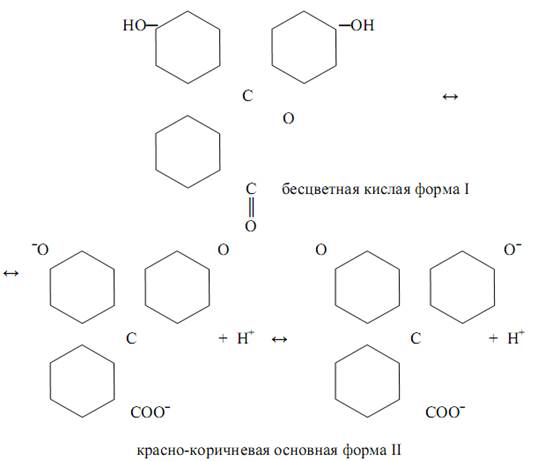
Кислотно-основные индикаторы, как правило, - обратимые индика-торы, способные обратимо изменять окраску в зависимости рН раствора. Предложено более 200 органических соединений в качестве кислотно-основных индикаторов, относящихся к различным структурным типам.
|
из
5.00
|
Обсуждение в статье: Теории кислотно-основных индикаторов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

