 |
Главная |
Метод нормального потенциала Плескова
|
из
5.00
|
Исследуя потенциалы щелочных металлов — лития, натрия, калия , рубидия, цезия, - Плесков установил, что э. д. с. цепи Rb|Rb+||Cs+|Cs оказывается неизменной во многих растворителях. На основании этого Плесков высказал предположение о том, что потенциал цезиевого или рубидиевого электродов следует считать неизменным в различных растворителях, т, е. считать, что э. д. с. Pt(H2)|H+||Cs+|Сs при переходе от одного растворителя к другому изменяется не за счет цезиевого электрода, а только за счет водородного электрода.
Однако неизменность разности потенциалов рубидия и цезия не означает, что каждый из этих потенциалов не изменяется при переходе от растворителя к растворителю - они изменяются, но в одинаковой степени.
Этот вывод был сделан на том основании , что изменение потенциала цепи Hg(Cs) | CsCl | AgCl, Ag при переходе от воды к спирту близко к изменению потенциала цепи Pt(H2)|HCl|AgCl, Ag. В этих цепях анионы одинаковы; следовательно, изменения потенциалов водородного и цезиевого электродов (во всяком случае при переходе от воды к спиртам) близки между собой. Поэтому не было оснований предполагать,, что изменение потенциала цепи Pt(H2)|H+|Сs+| Cs во всех растворителях обязано только водородному электроду; изменение потенциала обязано и водородному и цезиевому электродам. Это говорит о том, что в общем нельзя основывать оценку кислотности в неводных растворах на предположении Плескова.
Предположение Плескова оправдывается но отношению к растворителям с высокой диэлектрической проницаемостью и резко отличной от воды основностью (аммиак и муравьиная кислота), однако нельзя распространить этот результат на другие растворители без экспериментальной проверки.
Строго, единая кислотность, которую мы обозначаем рА, отнесенная к воде в качестве единого стандартного состояния, определяется величиной отрицательного логарифма активности иона МН+:
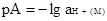 (2.5.1)
(2.5.1)
где 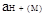 абсолютная активность иона МН+ ,отнесенная к активности протона в разбавленном водном растворе в качестве единого стандартного состояния.
абсолютная активность иона МН+ ,отнесенная к активности протона в разбавленном водном растворе в качестве единого стандартного состояния.
Такая оценка кислотности является термодинамически строго обоснованной. Единая активность ионов лиония, отнесенная к воде в качестве стандартного состояния, может быть выражена так:
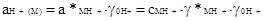 (2.5.2)
(2.5.2)
Подставляя эту величину в уравнение (2.5.1), получим:
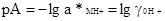 (2.5.3)
(2.5.3)
в котором активность а* отнесена к бесконечно разбавленному раствору ионов в неводной среде, а коэффициент 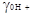
 отнесен к воде в качестве стандартного состояния.
отнесен к воде в качестве стандартного состояния.
Величина —lg а*МН+ называется рНр. Она может быть измерена для любого неводного раствора против стандарта в том же самом неводном растворе. В определении этой величины затруднений нет.
Следовательно
pA = pHр 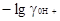 (2.5.4)
(2.5.4)
Это однозначное определение величины рА.
2.6. Применение средних коэффициентов активности 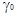 ионов для оценки единой шкалы кислотности
ионов для оценки единой шкалы кислотности
Для оценки единой шкалы кислотности можно воспользоваться средними коэффициентами активности ионов сильной соляной кислоты.
Было установлено, что они могут быть определены только для суммы электролитов в целом. Эти величины хорошо известны для ионов ряда сильных кислот, особенно для HCl во многих растворителях. Например, для этилового спирта 2lg 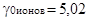 . Однако какая часть величины 5,02 составляет lg
. Однако какая часть величины 5,02 составляет lg 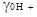 и какая часть lg
и какая часть lg 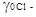 мы не знаем. В связи с этим было предложено поступать так: принять, что средний коэффициент активности ионов кислоты равен коэффициенту активности ионов лиония, т. е. предположить, что:
мы не знаем. В связи с этим было предложено поступать так: принять, что средний коэффициент активности ионов кислоты равен коэффициенту активности ионов лиония, т. е. предположить, что:
lg 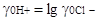 (2.6.1)
(2.6.1)
Из этого предположения следует, что величина рА определяется выражением
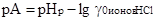 (2.6.2)
(2.6.2)
Такой прием вносит определенную ошибку, обусловленную различием в величинах 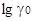 протонов и анионов кислот, однако сравнение
протонов и анионов кислот, однако сравнение 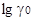 для разных кислот показало, что эти величины близки между собой; например,
для разных кислот показало, что эти величины близки между собой; например,
и этиловом спирте 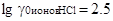 ,
, 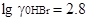 ,
, 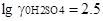 и т.д. Это же наблюдается и для других растворителей.
и т.д. Это же наблюдается и для других растворителей.
Эксперименты показывают, что величины 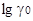 ионов кислот в спиртам лишь несколько отличаются от величины:
ионов кислот в спиртам лишь несколько отличаются от величины: 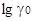 ионов солей. Поэтому нельзя предполагать, что изменения энергии сольватации ионов лиония резко отличается от изменения энергии сольватации остальных катионов. Во всяком случае, величина
ионов солей. Поэтому нельзя предполагать, что изменения энергии сольватации ионов лиония резко отличается от изменения энергии сольватации остальных катионов. Во всяком случае, величина 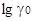 ионов кислот является вполне однозначной и, вероятно, оценивает изменение кислотности с большей надежностью, чем величины Н0, Н(-), рННас и т.д.
ионов кислот является вполне однозначной и, вероятно, оценивает изменение кислотности с большей надежностью, чем величины Н0, Н(-), рННас и т.д.
2.7 Нахождение единой кислотности рА с помощью 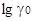 протонов
протонов
Все перечисленные выше методы не позволяют однозначно оценить кислотность неводных растворов в единой шкале. Вопрос об этой шкале может быть решен только на основании данных о величинах химической энергии сольватации протонов в различных растворителях. Эти данные получены на основании подсчетов сумм и разностей химических энергий сольватации ионов в неводных растворах из данных об электродвижущих силах цепей без переноса и с переносом в неводных растворах. Путем экстраполяции величин суммарной энергии сольватации ионов водорода и ионов галогенов (ионы галогеноводородных кислот) и разностей энергий сольватации ионов водорода и ионов щелочных металлов была определена энергия сольватации протона и других ионов в различных растворителях.
При переходе от водного к неводному раствору следует считаться с том, что протяженность шкалы различна для разных растворителей. Для того чтобы оценить абсолютную кислотность, кроме протяженности шкалы нужно знать, как смещено начало шкалы кислотности одного растворителя но отношению к шкале кислотности воды.
Использование 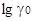 протонов в различных растворителях в качестве единой меры изменения кислотности в разных растворителях однозначно характеризует величину смещения шкал кислотности.
протонов в различных растворителях в качестве единой меры изменения кислотности в разных растворителях однозначно характеризует величину смещения шкал кислотности.
Обозначим начало шкалы для воды через 0; шкала для этилового спирта имеет протяженность 19,3; если 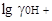 = 4,2, то очевидно, что шкала в этиловом спирте начинается в области —4,2 и заканчивается при рА = 15,1. У метилового спирта
= 4,2, то очевидно, что шкала в этиловом спирте начинается в области —4,2 и заканчивается при рА = 15,1. У метилового спирта 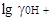 = 3,3, а вся шкала 16,9; шкала для него расположится от - 3,3 до +13,6;
= 3,3, а вся шкала 16,9; шкала для него расположится от - 3,3 до +13,6; 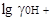 в муравьиной кислоте
в муравьиной кислоте 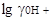 = 8,6, вся шкала равна 6,1, она расположена между -8,6 и -2,5. У аммиака протяженность шкалы 32,7; она смещена по отношению к воде на 16,4 единицы, начало шкалы будет при рА = 16,4, а конец при рА = 49,1. Из этих сопоставлений следует, что самый щелочной раствор в муравьиной кислоте будет кислее самого кислого раствора в воде и самый кислый раствор в аммиаке щелочнее самого щелочного раствора в воде,
= 8,6, вся шкала равна 6,1, она расположена между -8,6 и -2,5. У аммиака протяженность шкалы 32,7; она смещена по отношению к воде на 16,4 единицы, начало шкалы будет при рА = 16,4, а конец при рА = 49,1. Из этих сопоставлений следует, что самый щелочной раствор в муравьиной кислоте будет кислее самого кислого раствора в воде и самый кислый раствор в аммиаке щелочнее самого щелочного раствора в воде,
Относительное расположение шкалы рНр позволяет оценить отношение между единой кислотностью растворов и величиной рНр. Из рис. 2 следует, что раствор кислоты в спирте, в котором активность а*=(рНр= 0), кислее соответствующего йодного раствори на 4,2единицы.
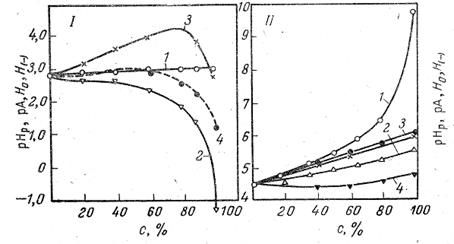
Рис. 2. Изменение рНр (1), рА (2), Н0 (3), и Н(-) (4) растворов HCl (I), и ацетатного буфера (II) в растворах этилового спирта в воде.
Однако не нужно думать, что всякий раствор кислоты в этиловом спирте будет кислее, чем в воде. В действительности рА нормального раствора соляной кислоты в этиловом спирте не будет равна -4,2, так как в нем величина 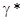 значительно меньше величины
значительно меньше величины 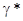 в воде.
в воде.
Таким образом, в этиловом спирте, с одной стороны, 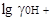 положителен, и это приводит к уменьшению рА и увеличению кислотности. С другой стороны, lg
положителен, и это приводит к уменьшению рА и увеличению кислотности. С другой стороны, lg 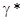 отрицательны и по абсолютной величине больше, чем у воды, а это приводит к увеличению рНр и к уменьшению кислотности. В 1 н. растворе HCl в этиловом спирте величина
отрицательны и по абсолютной величине больше, чем у воды, а это приводит к увеличению рНр и к уменьшению кислотности. В 1 н. растворе HCl в этиловом спирте величина 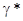 = 0,157. В результате этого рА 1 н раствора HCl в этиловом спирте будет не -4,2, а значительно меньше (только -3,3), но все же раствор в этиловом спирте значительно кислее, том в воде.
= 0,157. В результате этого рА 1 н раствора HCl в этиловом спирте будет не -4,2, а значительно меньше (только -3,3), но все же раствор в этиловом спирте значительно кислее, том в воде.
Можно сказать, что в этиловом спирте каждый ион лиония становится активнее, по число ионов лиония становится меньше.
Еще резче это будет проявляться в спиртовых растворах уксусной кислоты: с одной стороны, кислотность ионов лиония С2Н5ОН2+ по сравнению с водой увеличивается на 4,2 единицы, но, с другой стороны, константа диссоциации кислоты при переходе от воды к этиловому спирту уменьшается на 5,6 порядка, и оба эффекта в значительной степени компенсируются. Величина рА ацетатного буферного раствора только 5,5. Повышение абсолютной кислотности будет особенно большим только в разбавленных растворах сильных кислот, в которых 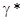 = 1.
= 1.
Для иллюстрации на рис. 2 приведены данные для рН и рА разбавленных растворов сильной соляной кислоты (0,002 н. НС1 + 0,008 н. NаCl) и буферных растворов, состоящих из 0,02 н. НАс и 0,01 п. NaAc + 0,0005 н. NaCl в смесях этилового спирта с водой.
Из рис.2 следует, что рНр разбавленных растворов соляной кислоты практически не изменяются при переходе от воды к спиртам. Наоборот, рА резко падают. В отличие от этого рНр ацетатного буфера сильно возрастают в связи со значительным ослаблением силы кислоты.. Величина рА этого буфера изменяется мало и не уменьшается, как в случае растворов HCl, а несколько возрастает. Из рис, 2 следует также, что ни H0,ни Н(-) не передают действительного хода зависимости единой кислотности с изменением растворителя. Более того, Н(-)одного и того же раствора, измеренная с помощью различных индикаторов [2,4-динитрофенол (Н(-))и димедон (Н’(-))],расходятся. В этиловом спирте они отличаются более чем на единицу рА. Еще большее расхождение между рА, Н0 и Н(-) для раствором сильных кислот, где они разнятся на 2—4 единицы.
Буферные растворы
Буферными называют растворы, рН которых практически на изменяется от добавления к ним небольших количеств сильной кислоты или щелочи, а также при разведении. Простейший буферный раствор – это смесь слабой кислоты и соли, имеющей с этой кислотой общий анион (например, смесь уксусной кислоты СН3СООН и ацетата натрия СН3СООNa), либо смесь слабого основания и соли, имеющей с этим основанием общий катион (например, смесь гидроксида аммония NH4OH с хлоридом аммония NH4Cl).
С точки зрения протонной теории1 буферное действие растворов обусловлено наличием кислотно-основного равновесия общего типа:
Воснование + Н+ Û ВН+сопряженная кислота
НАкислота Û Н+ + А-сопряженное основание
Сопряженные кислотно-основные пары В /ВН+ и А- /НА называют буферными системами.
3.1.Классификация кислотно-основных буферных систем.
Буферные системы могут быть четырех типов:
1. Слабая кислота и ее анион А- /НА:
· Ацетатная буферная система СН3СОО-/СН3СООН в растворе СН3СООNa и СН3СООН, область действия рН 3, 8 – 5, 8.
· Водород-карбонатная система НСО3-/Н2СО3 в растворе NaНСО3 и Н2СО3, область её действия – рН 5, 4 – 7, 4.
2. Слабое основание и его катион В/ВН+:
· аммиачная буферная система NH3/NH4+ в растворе NH3 и NH4Cl,
область ее действия – рН 8, 2 – 10, 2.
3. Анионы кислой и средней соли или двух кислых солей:
· карбонатная буферная системаСО32- /НСО3- в растворе Na2CO3 и NaHCO3, область ее действия рН 9, 3 – 11, 3.
фосфатная буферная системаНРО42-/Н2РО4- в растворе Nа2НРО4 и NаН2РО4, область ее действия рН 6, 2 – 8, 2
Эти солевые буферные системы можно отнести к 1-му типу, т. к. одна из солей этих буферных систем выполняет функцию слабой кислоты. Так, в фосфатной буферной системе анион Н2РО4- является слабой кислотой.
4. Ионы и молекулы амфолитов. К ним относят аминокислотные и белковые буферные системы. Если аминокислоты или белки находятся в изоэлектрическом состоянии (суммарный заряд молекулы равен нулю), то растворы этих соединений не являются буферными.Они начинают проявлять буферное действие, когда к ним добавляют некоторое количество кислоты или щелочи. Тогда часть белка (аминокислоты) переходит из ИЭС в форму “белок-кислота” или соответственно в форму “белок-основание”. При этом образуется смесь двух форм белка: (R – макромолекулярный остаток белка)
а) слабая “белок-кислота” + соль этой слабой кислоты:

 СОО- СООН
СОО- СООН

 R – СН + Н+ Û R – СН
R – СН + Н+ Û R – СН
N+Н3 N+Н3
основание А- сопряженная кислота НА
(соль белка-килоты) (белок-кислота)
б) слабое “белок-основание” + соль этого слабого основания:

 СОО- СОО-
СОО- СОО-

 R – СН + ОН- Û R – СН + Н2О
R – СН + ОН- Û R – СН + Н2О
N+Н3 NН2
кислота ВН+ сопряженное основание В
(соль белка-основания) (белок-основание)
|
из
5.00
|
Обсуждение в статье: Метод нормального потенциала Плескова |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

