 |
Главная |
Г. Транскраниальная допплерография
|
из
5.00
|
Первым этапом исследования определяется местоположение акустического "окна", через которое ультразвуковой луч может проникнуть с минимальной потерей энергии. Основным условием является выбор удачного угла зондирования и положения датчика для получения оптимального сигнала.
Следующим этапом проводится идентификация сегментов артериальной сети у основания черепа. Она основана, во-первых, на знаниях анатомии и, во - вторых, на учете особенностей кровотока в различных артериальных сегментах и его реакции на компрессию ОСА.
Локализация и поиск акустических ультразвуковых окон для
исследования внутричерепных артерий
Описаны три основных пути локации внутричерепных артерий (Рис 1.13.):
* Темпоральное окно (исследование СМА, ПМА и артерий виллизиева круга).
* Орбитальное окно (глазничная артерия, сифон внутренней сонной артерии).
* Субокципитальное окно (основная артерия, внутричерепные сегменты позвоночных артерий).

Рис 1.13 Акустические окна для транскраниального исследования.
1- темпоральное, 2- орбитальное, 3- субокципитальное.
Полноценное исследование проводится через все три акустических окна, и позволяет, таким образом, исследовать большую часть внутричерепных артерий.
1. Темпоральное окно
Исследование через темпоральное окно является основным, открывая доступ к ПМА, СМА, ЗМА и ВСА, а также позволяет определить функцию передней соединительной и задней соединительной артерий.
Локация в височной области проводится через чешую височной кости. У молодых пациентов, как правило, можно получить достоверные сигналы в относительно большой области. У пациентов старшего возраста толщина костей или их плотность меняется настолько, что нередко едва возможно получить достоверные сигналы из-за уменьшения акустической проницаемости. Во всех случаях следует передвигать зонд медленно, мелкими шагами, обращая внимание на обеспечение хорошего ультразвукового контакта между датчиком и кожей, что обеспечивается нанесением достаточного количества ультразвукового геля не только на датчики, но и волосы и кожу пациента.
В этом случае для получения хорошего ультразвукового контакта понадобится только умеренное давление на зонд, поскольку избыточное давление приводит к нарушению ультразвукового контакта.
Темпоральные окна расположены над скуловой дугой. Приблизительное расположение дуги можно определить пальпацией. Часто оказывается необхо-димым поместить зонд нижним ободом на выпуклость над скуловой дугой, чтобы пропустить ультразвуковой пучок точно над верхним краем дуги. В очень ред-ких случаях окна располагаются над скуловой дугой на расстоянии больше 3 см.
Различают три положения темпорального окна:
Переднее окно (AW) расположено над проксимальной частью скуловой дуги.
Заднее окно (PW) расположено впереди уха. В некоторых случаях это окно лежит выше остальных.
Среднее окно (MW) расположено между AW и PW.
бычно, в случае AW зонд направлен наклонно и слегка кзади. В случае PW зонд расположен кпереди, чтобы ультразвуковой пучок достиг артерий виллизиева круга. При MW датчик располагается так, чтобы ультразвуковой пучок проходил перпендикулярно поверхности кожи.
В некоторых случаях для исследования используют все три, но типичным является использование только одного темпорального окна. Зондирование через PW является лучшим для пациентов старшего возраста. Необходимо исследовать все три области, чтобы выбрать лучшее из возможных окон.
Локация базальных артерий через темпоральное окно представляет значительные трудности для начинающего исследователя. Следует проявить должное терпение, настойчивость и элементы творчества для овладения этим методом диагностики. Так, здесь описаны общепринятые способы локации через темпоральное окно. На практике оказывается, что "акустический ход" ультразвукового луча подвержен индивидуальным особенностям. Поскольку основная цель исследования - получение достоверной информации от искомой артерии, не суть важно, под каким углом и в какой части акустического окна она получена.
Поиск акустического окна
Поиск акустического окна рекомендуется начинать на глубине 55 - 60 мм. На этом уровне можно получить ультразвуковой сигнал от сифона сонной артерии, СМА, ПМА и ЗМА. Во время процедуры поиска следует мысленно представлять приблизительное расположение базальных мозговых артерий и соответственно направлять ось датчика (рис. 1.3). Одновременно с этим датчик медленно перемещают для получения качественного сигнала.
После получения сигнала оптимальной силы и чистоты следует мысленно зафиксировать удачное положение датчика во избежание повторных манипуляций поиска оптимального окна.
Идентификация артерий
Критерии идентификации:
* Глубина и угол зондирования.
* Направление кровотока (к датчику или от него).
* Реакция кровотока на компрессию ОСА.
Компрессию общей сонной артерии следует проводить как можно ниже на шее для исключения раздражающего воздействия на каротидный клубочек (брадикардия, аритмия), а также сдавливания атеросклеротической бляшки (риск развития артерио - артериальной эмболии). Обычная продолжительность компрессии ОСА - 2-3 сек.

Рис 1.14. Примерное направление оси ультразвукового датчика при
исследовании базальных артерий через темпоральное окно.
1- IV сегмент левой ПА, 2- ОА, 3- ЗМА,
4 - ЗСА, 5- ПСА, 6- СМА, 7- ПМА.
Внутренняя сонная артерия
После того, как найдено оптимальное положение датчика, можно приступать к локации терминального отдела ВСА (точно дифференцировать уровни терминального отдела ВСА или ее сифона весьма затруднительно и, по сути, не столь важно).
Идентификацию проводят по следующим критериям:
1. Кровоток (по направлению к датчику) обнаруживается на глубине 65 -75 мм (зависит от размеров черепа). Ориентировочно ось датчика направляется на нижний край противоположной орбиты глаза, поскольку получаемый сигнал формируется приблизительно на уровне виллизиева круга. Скорость кровотока в дистальном сегменте ВСА ниже, чем в СМА и ПМА (локация под тупым углом).
2. Двунаправленный кровоток (в обоих направлениях) наблюдается примерно на той же глубине (при разделении потока крови) в области сифона или бифуркации ВСА (Рис 1.15).

Рис 1.15 Допплерограмма кровотока в сифоне ВСА.
3. Компрессия гомолатеральной ОСА приводит к ослаблению или редукции по-лученного сигнала.
4. Компрессия гомолатеральной ОСА приводит к изменению направления потока крови (инверсии сигнала).
5. Компрессия гомолатеральной ОСА приводит к редукции кровотока и вызывает компенсаторный кровоток из контралатеральной ВСА через ПСА.
Средняя мозговая артерия
СМА расположена латерально и немного cпереди, как продолжение внутри-черепного отдела ВСА. Локация через темпоральное окно достаточно точно соответствует абсолютному значению скорости кровотока в СМА (угол между вектором потока крови и направлением УЗ датчика приближается к нулю) (Рис 1.16, поз. A). Критериями для идентификации СМА являются:
1. Кровоток в МI сегменте СМА лоцируется на глубине 55-65 мм.
2. Направление кровотока к датчику (рис. 1.1.6.).

Рис. 1.16. Допплерограмма кровотока в МI сегменте СМА.
3. Сигнал отвечает редукцией или ослаблением при компрессии гомолатеральной ОСА (рис. 1.17).

Рис. 1.17 Допплерограмма кровотока в СМА с компрессией гомолатеральной ОСА.
1.1.5. Сравнительный анализ ультразвуковых допплеровских датчиков
Одним из принципов работы УЗ допплеровского прибора является пьезоэлектрический эффект. Именно благодаря этому эффекту возможно преобразование акустической в электрическую энергию и наоборот, и, таким образом, электрическая регистрация неэлектрических величин, таких как скорость кровотока.
Пьезоэлектрический эффект представляет собой явление, которое наблюдается в образцах некоторых анизотропных материалов и заключается в нарушении равновесного распределения электрических зарядов под действием механической деформации образца. Возможен и обратный пьезоэффект, состоящий в механической деформации среды под действием электрического поля. В настоящее время известно довольно много моно- и поликристаллических материалов, обладающих пьезоэлектрическими свойствами. Наиболее широкое применение находят монокристаллические, керамические и полупроводниковые пьезоэлектрики. Идеальным пьезоэлектрическим материалом для электроакустического преобразователя является такой материал, который обеспечивает низкий уровень шума, высокую эффективность преобразования и позволяет создать преобразователь с высокой добротностью. Обычно активный элемент ультразвукового датчика изготавливается из пьезокерамической керамики. Самым распространенным пьезокерамическим материалом является цирконат-титанат свинца (ЦТС). Также находят свое применение датчики из пластических материалов, например поливинилиденфторида (ПВДФ), имеющих, по сравнению с керамикой, более близкие мягким тканям человеческого организма характеристики, что более эффективно с точки зрения передачи акустической энергии через границу активный элемент – исследуемая среда. Также свое применение находят датчики, построенные на комбинации пластика и керамики, например, с керамическим передающим и пластиковым принимающим элементами.
Конструктивно разделяются датчики, работающие в непрерывно-волновом и импульсных режимах. Прием и излучение ультразвука для первого из них разнесены в пространстве, для второго – во времени. Таким образом, первый состоит из двух активных элементов, расположенных вплотную и под некоторым углом друг к другу, а второй имеет в своем составе только один, поочередно работающий то на прием, то на передачу (рис. 1.18).

Рис. 1.18 Непрерывно-волновой (а) и импульсный (б) УЗ допплеровские датчики
На переднюю и заднюю поверхность активных элементов – пьезоэлектриков вжигаются проводящие электроды из серебра, после чего он поляризуется по толщине в электрическом поле. Скорость звука в ЦТС составляет приблизительно 4000 м/с; при этом толщина пьезоэлемента  , соответствующая основному резонансу (
, соответствующая основному резонансу (  ) на частоте
) на частоте  , определяется соотношением
, определяется соотношением
 (2.5)
(2.5)
В следующей таблице приведены толщины пьезоэлементов УЗ датчиков для работы на частотах 2, 4, 8, 10, 16 и 20 МГц, изготовленных из ЦТС.
Таблица 2.1. Зависимость толщины пьезоэлемента от частоты излучаемого ультразвука.
| Частота, МГц | 2 | 4 | 8 | 10 | 16 | 20 |
| Толщина, мм | 1 | 0,5 | 0,25 | 0,2 | 0,125 | 0,1 |
Из данной таблицы видно, что на частотах свыше 10 МГц толщина активного элемента становится меньше 0.2 мм. Обработка материала такой толщины затруднена, из-за хрупкости образца. Электрические контакты, напыляемые на противоположные поверхности пьезокерамической пластины, из-за существования пор в объеме керамики могут образовывать электрические соединения друг с другом через эти поры, и такой преобразователь становится непригодным для работы.
1.1.6. Исследование зависимости глубины проникновения от частоты излучаемого ультразвукового сигнала
Одним из основополагающих механизмов, ограничивающим область применения высокочастотной УЗ допплеровской аппаратуры, является быстрое (экспоненциальное) возрастание затухания ультразвука в тканях человеческого тела с ростом частоты колебаний.
Для повышения чувствительности и для увеличения глубины зондирования увеличивают интенсивность ультразвуковых колебаний. Однако это увеличение ограничено условиями безопасности обследования, т.к. при существенном повышении интенсивности ультразвука возможен нагрев и даже разрушение биологической структуры. По ГОСТу 26831-86, предел полностью безопасной дозы интенсивности при воздействии УЗ на человеческий организм составляет 50 мВт/см2.
С другой стороны, работа УЗ допплеровского прибора всецело обусловлена релеевским рассеянием, а одним из следствий механизма релеевского рассеяния, является четвертая степень зависимости энергии рассеянного сигнала от частоты излучаемого ультразвука. Т.е.красные кровяные тельца, являющиеся основными движущимися отражателями в исследуемом кровотоке, рассеивают УЗ высокой частоты лучше, чем УЗ низкой частоты. Этот эффект позволяет частично компенсировать повышенное затухание УЗ высокой частоты.
Совокупность двух указанных факторов приводит к тому, что существует оптимальное значение частоты, обеспечивающее максимальное соотношение сигнал/шум для каждого частного случая (т.е. коэффициента затухания и глубины залегания исследуемого сосуда). Данное значение можно получить математически. Как было отмечено, в случае релеевского рассеивания, интенсивность обратного рассеивания УЗ связана с частотой  , на которой проводятся исследования, следующим соотношением:
, на которой проводятся исследования, следующим соотношением:

где  - коэффициент рассеивания. Ввиду затухания УЗ в ткани, его интенсивность уменьшается с глубиной по закону
- коэффициент рассеивания. Ввиду затухания УЗ в ткани, его интенсивность уменьшается с глубиной по закону

где  - интенсивность падающего УЗ, знак “-“ указывает на затухающий характер данной функции, коэффициент 2 определяет двойное расстояние (до сосуда и обратно),
- интенсивность падающего УЗ, знак “-“ указывает на затухающий характер данной функции, коэффициент 2 определяет двойное расстояние (до сосуда и обратно),  - коэффициент затухания, зависящий от типа ткани,
- коэффициент затухания, зависящий от типа ткани,  - глубина исследуемого сосуда. Очевидно, что интенсивность отраженного от кровотока в исследуемом сосуде сигнала будет определяться произведением этих функций:
- глубина исследуемого сосуда. Очевидно, что интенсивность отраженного от кровотока в исследуемом сосуде сигнала будет определяться произведением этих функций:
 (1)
(1)
График этого выражения, представленного в виде функции  , для нескольких глубин исследуемых сосудов изображен на рис. 1.19
, для нескольких глубин исследуемых сосудов изображен на рис. 1.19

Рис. 1.19. Зависимость интенсивности отраженного сигнала от частоты излучаемого УЗ
Как видно из графика, для каждой глубины расположения исследуемого сосуда существует определенная частота УЗ сигнала, при которой на приемник возвращается максимум излученной энергии. Эту частоту можно найти, продифференцировав (1) по  , и приравняв полученное выражение нулю. Ненулевой корень последнего уравнения имеет вид:
, и приравняв полученное выражение нулю. Ненулевой корень последнего уравнения имеет вид:
 (2)
(2)
Коэффициент a, может изменяться для мягких тканей от 0.2 дБ/МГц·см до более чем 2 дБ/МГц·см (в зависимости от вида ткани).
График на рис. 1.20иллюстрирует зависимость расчетного диапазона частот как функции глубины зондирования мышечной ткани. Эта зависимость соответствует максимальному отношению сигнал/шум при регистрации УЗ‑сигналов, рассеянных на элементах крови. Заштрихованная область на графике соответствует различным величинам коэффициента затухания a.

Рис. 1.20 Оптимальная частота УЗ сигнала для исследования на заданной глубине
Как видно из данного графика, для существующих в настоящее время ультразвуковых допплеровских приборов, работающих на частотах до 20 МГц, предпочтительными являются глубины более 0,5 см. В то же время, оптимальной для высокочастотных приборов, с точки зрения соотношения сигнал/шум и получения максимальной мощности отраженного сигнала, является глубина расположения исследуемых сосудов, меньшая, чем 0,5 см.
1.1.7. Анализ структурных схем существующих ультразвуковых допплеровских приборов
Рассмотрим схемотехнику наиболее распространенных вариантов УЗ допплеровских приборов.
Непрерывно‑волновой ультразвуковой допплеровский прибор
со звуковой индикацией без выделения информации о направлении кровотока
Для построения допплеровских индикаторов скорости кровотока используются ряд известных радиотехнических узлов и блоков, применяющихся в коротковолновых приемо-передающих устройствах и доработанных с учетом специфики взаимодействия с электроакустическим элементом допплеровского прибора – ультразвуковым датчиком .
Блок схема простейшего непрерывно-волнового УЗ прибора со звуковой индикацией без выделения информации о направлении кровотока показана на рис. 1.21
 |
Рис. 1.21 Блок схема непрерывно-волнового допплеровского прибора со звуковой индикацией без выделения информации о направлении кровотока
1 – УЗ датчик, 2 – УМ, 3 – предварительный усилитель, 4 – задающий генератор, 5 – синхронный детектор, 6 – кварцевый резонатор, 7 – полосовой фильтр, 8 – УНЧ,
9 – громкоговоритель.
Рассмотрим работу данного индикатора. Вырабатываемый задающим генератором 4 (частота которого стабилизируется кварцевым резонатором 6) сигнал подается на вход усилителя мощности (УМ) 2, усиливается последним и излучается в виде акустической волны, сфокусированной УЗ преобразователем 1 по направлению исследуемого сосуда. Отраженный сигнал, несущий информацию о движении форменных элементов крови в данном сосуде, преобразуется приемным элементом УЗ датчика, усиливается предварительным усилителем с малым уровнем шумов 3 и детектируется синхронным детектором 5, управляемым задающим генератором 4.
Эхосигнал содержит спектр доплеровских частот, обусловленный движением отдельных элементов кровотока в анализируемом объеме. Этот сигнал можно представить в виде суперпозиции сигналов, привносимых всеми линиями тока, проходящими через измерительный объем. Вклад каждой компоненты в этот сигнал пропорционален мощности ультразвука, рассеянной элементами кровотока вдоль данной линии, т.е. интегралу по линии тока от чувствительности в пучке (зависимости величины сигнала, принятого от точечного рассеивателя, от координат этого рассеивателя).
Для упрощения последующих выкладок, рассмотрим сигнал на выходе блока 3, как состоящий из трех компонентов: несущей частоты и сигналов, отраженных от прямого и обратного кровотоков. Такой сигнал может быть представлен в виде:
 (3)
(3)
где  ,
,  и
и 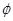 - соответственно амплитуда, угловая частота и фаза каждого сигнала, а индексы 0, f и r обозначают несущую, прямой и обратный кровоток.
- соответственно амплитуда, угловая частота и фаза каждого сигнала, а индексы 0, f и r обозначают несущую, прямой и обратный кровоток.
Этот сигнал поступает на детектор 5. С математической точки зрения детектор представляет собой перемножитель двух сигналов. Умножая данное выражение на  - сигнал с выхода опорного генератора, получаем сигнал на выходе синхронного детектора 5:
- сигнал с выхода опорного генератора, получаем сигнал на выходе синхронного детектора 5:
 (4)
(4)
Этот сигнал далее фильтруется полосовым фильтром 7 для устранения низкочастотных помех, возникающих вследствие отражения УЗ сигнала от медленно движущихся стенок сосуда (амплитуда сигнала от которых на несколько порядков выше амплитуды полезного допплеровского сигнала), постоянной составляющей  и ВЧ шума (включая
и ВЧ шума (включая  ,
,  и
и  ).
).
Выражение для отфильтрованного сигнала имеет вид:
 (5)
(5)
Данный сигнал подается затем на усилитель низкой частоты (УНЧ) 8 для воспроизведения посредством наушников (или громкоговорителей) 9.
Синхронное детектирование
Для ультразвукового допплеровского диагностического прибора принимаемый сигнал, несущий информацию о распределении кровотока в исследуемом сосуде, сравним с шумом. Амплитуда сигнала, отраженного от медленно движущихся стенок сосудов на несколько порядков превосходит полезный сигнал. Кроме этого, на входе приемного усилителя присутствует так называемый сигнал пролезания, т.е. сигнал, проникающий в приемный тракт посредством акустической и электрической связи, существующей между передающей и приемной частями прибора. Не последнюю роль в этом процессе играет и недостаточная экранировка ультразвукового датчика.
Исходя из вышеизложенного, а также из того, что принимаемый полезный сигнал промодулирован по частоте, вследствии выбранного принципа регистрации кровотока, излучаемым сигналом, синхронное детектирование является естественным способом выделения полезного сигнала.
Импульсный ультразвуковой допплеровский прибор со звуковой индикацией без выделения информации о направлении кровотока.
Блок‑схема импульсного УЗ допплеровского прибора со звуковой индикацией без выделения информации о направлении кровотокапоказана на рис. 1.22

Рис. 1.22 Блок-схема импульсного УЗ допплеровского прибора со звуковой индикацией без выделения информации о направлении кровотока
1 – УЗ датчик, 2 – УМ, 3 – предварительный усилитель, 4 - формирователь импульсов разрешения передачи, 5 – селектор передачи, 6 – селектор приема, 7 - формирователь импульсов разрешения приема (линия задержки), 8 - задающий генератор, 9 – синхронный детектор, 10 – УВХ, 11 – кварцевый резонатор, 12 – полосовой фильтр, 13 – УНЧ, 14 – громкоговоритель.
Как видно, импульсный прибор отличается от непрерывно-волнового наличием формирователя импульсов разрешения передачи и приема, а также селекторов передачи и приема, управляемых этими импульсами. Вырабатываемый опорным генератором 8 сигнал стробируется селектором передачи 5 в строго определенные промежутки времени, задаваемые формирователем импульсов разрешения передачи 4. Принятый сигнал также стробируется по времени селектором приема 6, а продетектированный синхронным детектором 9 сигнал запоминается в устройстве выборки и хранения (УВХ) 10 до прихода следующего импульса. Положение “объема выборки” на оси УЗ датчика или глубина расположения исследуемого сосуда определяется временной задержкой между импульсом излучения и стробом приема, открывающего селектор приема 6. Эта задержка задается формирователем импульсов разрешения приема 7.
Так как амплитуда принятого продетектированного сигнала определяется мощностью излученного ультразвука, а из-за импульсного характера излучения при одинаковой амплитуде излучаемых сигналов непрерывно-волнового и импульсного приборов средняя излучаемая мощность последнего будет меньше, то на УМ импульсного тракта подается большее напряжение питания, по сравнению с непрерывно-волновым режимом для обеспечения поддержания уровня средней интенсивности излучаемого сигнала в импульсном режиме. УЗ датчик импульсного прибора представляет собой один пьезоэлектрический элемент, совмещающий функции приема и передачи, разнесенные во времени. Приемный тракт должен обеспечивать защиту входного каскада от перегрузок во время излучения.
В целом, работа импульсного УЗ допплеровского прибора аналогична работе радиолокационной станции обнаружения движущихся целей. Практически весь математический аппарат и многие схемотехнические решения, наработанные в военной области, без каких-либо изменений могут быть использованы в медицине и наоборот. В этом заключается смысл так называемых двойных направлений, развитие которых имеет огромное научное и практическое значение.
Синхронный квадратурный детектор и блок выделения информации о направлении кровотока
Описанные выше приборы не сохраняют информацию о направлении кровотока, а дает лишь величину сдвига частоты. Информация о направлении необходима, чтобы следить за изменением скорости кровотока в течении кардиоцикла в тех сосудах, где возникает обратный кровоток, или если направление кровотока несет диагностическую информацию, например, при исследовании вен при недостаточности сердечных клапанов .
Для того, чтобы разделить сигналы, несущие информацию о прямом и обратном кровотоке, наиболее широко в современных приборах применяется квадратурная демодуляция (рис. 1.23.).

Рис. 1.23 Блок схема квадратурного демодулятора
Х – перемножители, ПФ – полосовые фильтры.
Усиленный сигнал с выхода предварительного усилителя 3 (рис 1.21, 1.22) подается на два перемножителя Х, выполняющих роль детекторов, на управляющий вход одного из которых подается сигнал с выхода опорного генератора  , на управляющий вход другого – сигнал, сдвинутый относительно первого на
, на управляющий вход другого – сигнал, сдвинутый относительно первого на  , т.е.
, т.е.  . Таким образом, на выходе одного из каналов присутствует синфазный сигнал
. Таким образом, на выходе одного из каналов присутствует синфазный сигнал  , описываемый (5), на выходе второго – квадратурный сигнал
, описываемый (5), на выходе второго – квадратурный сигнал  , имеющий вид:
, имеющий вид:

или  (6)
(6)
Знак допплеровского сдвига, а значит, и направление кровотока определяется по соотношению фаз прямого (синфазного) и квадратурного каналов. Если этот сдвиг положителен, то квадратурный сигнал отстает на  от синфазного, и опережает в противном случае.
от синфазного, и опережает в противном случае.
Из выражений (5) и (6) следует, что для разделения сигналов необходимо “сдвинуть” один из каналов относительно другого на  , а затем произвести суммарно-разностную операцию над полученными сигналами.
, а затем произвести суммарно-разностную операцию над полученными сигналами.
Из предложенных до сих пор методов разделения сигналов прямого и обратного кровотока наибольшее развитие получили 2 метода:
· обработка прямого и квадратурного канала в фазовой области;
· применение цифровой обработки сигналов и, в частности, фильтра Гильберта.
 Первый метод поясняется на рис.1.1.7.2.3.
Первый метод поясняется на рис.1.1.7.2.3.
Рис. 1.24 Выделение сигналов прямого и обратного кровотока в фазовой области.
Оба сигнала, прямой и квадратурный, описываемые соответственно уравнениями (2.3) и (2.4), сдвигаются на  и суммируются с другим, несдвинутым, сигналом. В результате получаются два полностью разделенных канала.
и суммируются с другим, несдвинутым, сигналом. В результате получаются два полностью разделенных канала.
Так, сдвигая прямой сигнал  , описываемый (5), получаем:
, описываемый (5), получаем:

Суммирование с квадратурным сигналом  приводит к удалению компонента, относящегося к обратному кровотоку:
приводит к удалению компонента, относящегося к обратному кровотоку:

Точно также, сдвигая квадратурный канал 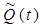 и суммируя с прямым каналом
и суммируя с прямым каналом  , получим компоненту обратного кровотока:
, получим компоненту обратного кровотока:

Второй подход основывается на применении фильтра Гильберта. ФГ представляет собой обычный, нерекурсивный фильтр. Именно из-за своего свойства сдвигать фазу на 90°, он применяется в модемах как детектор огибающей. Коэффициенты ФГ рассчитываются по формуле:

для  , где
, где  - порядок ФГ, и
- порядок ФГ, и  для
для 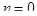 .
.
Так как ФГ реализуется в цифровом виде, обрабатываемый сигнал должен быть оцифрован посредством АЦП. В этом случае тракт обработки прямого и квадратурного канала имеет вид, показанный на рис. 1.25:

Рис.1.25 Выделение сигналов прямого и обратного кровотока в частотной области.
Здесь Z – линия задержки на половину длины ФГ. Таким образом, структурная схема непрерывно‑волнового УЗ допплеровского прибора
со звуковой индикацией и выделением информации о направлении кровотока выглядит как показано на рис. 1.26.
Отличие от ранее рассмотренной схемы – в блоках 5 и 7. Блок синхронного детектора 5 включает в себя схему формирования квадратурного сигнала, которая будет рассмотрена позднее и рассмотренную ранее схему квадратурного демодулятора рис. 1.24. Блок 7 содержит два полосовых фильтра и схему выделения информации о направлении кровотока – рис. 2.4. или 2.5., сигналы с выходов которых усиливаются посредством УНЧ и подаются на громкоговорители или головные телефоны 9.

Рис.1.26 Блок схема непрерывно-волнового допплеровского прибора с выделением информации о направлении скорости кровотока
1 – УЗ датчик, 2 – УМ, 3 – предварительный усилитель, 4 – задающий генератор, 5 – синхронный детектор и схема формирования квадратурных сигналов, 6 – кварцевый резонатор, 7 – полосовой фильтр и схема выделения сигналов прямого и обратного кровотока, 8 – УНЧ, 9 – громкоговорители.
Формирователь квадратурного сигнала.
Как было показано в п.1.1.6., для разделения каналов прямого и обратного кровотоков, необходимо сформировать два сигнала, сдвинутые один относительно другого на  . На практике вместо того, чтобы умножать сигнал
. На практике вместо того, чтобы умножать сигнал  на
на  и
и  , этот сигнал умножают на сигнал прямоугольной формы (меандр) с частотой, кратной
, этот сигнал умножают на сигнал прямоугольной формы (меандр) с частотой, кратной  . Аналитическое представление такого сигнала []:
. Аналитическое представление такого сигнала []:
 (7)
(7)
Как видно из приведенного выражения, синхронная демодуляция в этом случае сводится к синхронному детектированию посредством набора синхронных демодуляторов с коэффициентами усиления  и несущими частотами
и несущими частотами  . Входным избирательным усилителем, нивелирующим пролезание в низкочастотную область спектра выходного сигнала компонент с частотами
. Входным избирательным усилителем, нивелирующим пролезание в низкочастотную область спектра выходного сигнала компонент с частотами  является сам ультразвуковой датчик, работающий в области своего резонанса.
является сам ультразвуковой датчик, работающий в области своего резонанса.
Таким образом, задача демодуляции входного сигнала сводится к задаче детектирования этого сигнала с помощью простейшего аналогового ключа, управляемого сигналам, имеющим форму меандра, и описываемого (7).
Эта задача наиболее просто решается в цифровом виде при помощи трех D триггеров (рис.1.27).
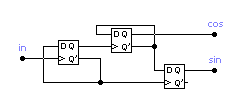
Рис. 1.27 Блок схема формирователя квадратурного сигнала.
Преимуществом данной схемы по сравнению с аналоговой является отсутствие дискретных компонентов и, как следствие, гораздо меньшие частотные, временные и температурные погрешности сдвига фаз.
Временная диаграмма для данной схемы приведена на рис. 1.28.

Рис. 1.28 Временная диаграмма работы формирователя квадратурного сигнала
Как видно из данной диаграммы, частота опорного сигнала должна быть выше частоты результирующих сигналов в четыре раза. Таким образом, для работы допплеровского прибора в диапазоне 2 МГц частота на выходе опорного генератора должна составлять 8 МГц, для 4 МГц – 16 МГц, и для 8 МГц – 32 МГц.
При построении приборов, работающих на частотах свыше 20 МГц, частота опорного генератора становится выше 80 МГц. При проектировании блоков генератора, формирователя квадратурного сигнала и смесителя, работающих на таких частотах, предъявляются повышенные требования к разводке печатной платы, ее экранировке, которые трудно обеспечить. Поэтому возникает отклонение разности фаз сигналов, подаваемых на квадратурный детектор от  , что приводит к проникновению этого отклонения в выходной сигнал, и, как следствие, к искажениям результатов обработки допплеровского сигнала.
, что приводит к проникновению этого отклонения в выходной сигнал, и, как следствие, к искажениям результатов обработки допплеровского сигнала.
Так, если сигнал, подаваемый на детектор прямого канала, имеет вид  , а сигнал, подаваемый на детектор квадратурного -
, а сигнал, подаваемый на детектор квадратурного -  , т.е. имеется ошибка сдвига опорного сигнала от величины
, т.е. имеется ошибка сдвига опорного сигнала от величины  , то в этом случае выражение для отфильтрованного квадратурного сигнала приобретает вид:
, то в этом случае выражение для отфильтрованного квадратурного сигнала приобретает вид:

Как нетрудно заметить, полученное выражение легко преобразуется в следующее:

Т.е. квадратурный сигнал в этом случае содержит часть прямого сигнала. Это – случай так называемого "пролезания" или отсутствия разделения каналов. Сдвиг этого сигнала на  аналоговым или цифровым способом и проведение над полученным результатом суммарно-разностной операции уже не приведет к полному разделению сигналов прямого и обратного кровотока, и результаты расчетов спектрограммы и индексов будут искажены.
аналоговым или цифровым способом и проведение над полученным результатом суммарно-разностной операции уже не приведет к полному разделению сигналов прямого и обратного кровотока, и результаты расчетов спектрограммы и индексов будут искажены.
На рис. 1.29 приведена смоделированная спектрограмма для случая  . Для примера на рис. 1.30 приведена таже самая спектрограмма для
. Для примера на рис. 1.30 приведена таже самая спектрограмма для  .
.

Рис. 1.29 Спектрограмма сигнала при наличии отклонения сдвига фаз опорного сигнала квадратурного детектора от величины 
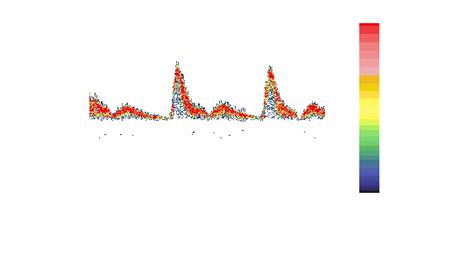
Рис. 1.30 Спектрограмма сигнала при отсутствии отклонения сдвига фаз опорного сигнала квадратурного детектора от величины 
Ультразвуковой спектроанализатор
Для количественной оценки параметров исследуемого кровотока применяются алгоритмы цифровой обработки сигналов (ЦОС) и, в частности, БПФ с последующим построением спектрограммы на экране монитора. Сигналы с выходов полосовых фильтров квадратурного детектора рис 1.23 дискретизируются посредством двухканального АЦП и подаются на вход блока ЦОС. Спектрограмма исследуемого кровотока представляет собо
|
из
5.00
|
Обсуждение в статье: Г. Транскраниальная допплерография |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

