 |
Главная |
На поверхности металлов
|
из
5.00
|
Лекции 6-8
ОСОБЕННОСТИ ИССЛЕДОВАНИЯ РЕАКЦИЙ
НА ПОВЕРХНОСТИ ТВЕРДЫХ ТЕЛ (4.2)
ПЛАН
4.2.1.Методы исследования поведения веществ на поверхности твердых тел
4.2.2.Особенности образования и поведения радикальных интермедиатов
на поверхности металлов
4.2.3.Исследование механизмов реакций методом сканирующей туннельной
микроскопии
4.2.3. Особенности исследование кинетических закономерностей реакции 3d-ме-
таллов и магния с бензилгалогенидами в диполярных апротонных растворителях
Методы исследования поведения веществ на поверхности твердых тел
Выбор метода исследования
В последние два десятилетия сильно возрос интерес к процессам, которые осуществляются на поверхности твердых тел, что привело к появлению большого количества работ, посвященной этой проблеме. Были разработаны новые методы и подходы, с помощью которых были исследованы особенности адсорбции и реакции на поверхности твердых тел различных соединений такие как, HREELS – спектроскопия характеристических потерь энергии электронами с высоким разрешением; MS – масс-спектрометрия; SSIMS – масс-спектрометрия вторичных ионов; TPD – температурно-программированная десорбция или реакция; Х/TPD – температурно-программированная десорбция или реакция с соадсорбированным на поверхности Х; XPS – рентгеновская фотоэлектронная спектроскопия; ∆ф – измерение изменения работы выхода электрона с поверхности, AES – электронная ОЖЕ-спектроскопия; GC – газовая хроматография; IR – ИК-спектроскопия, LEED – дифракция медленных электронов, STM – сканирующая туннельная микроскопия.
Применение этих методов исследования позволило получить достоверные сведения о механизмах целого ряда процессов, протекающих на поверхности твердых тел и уточнить уже имеющиеся данные.
Особенности образования и поведения радикальных интермедиатов
на поверхности металлов
Большой вклад в изучение реакций на поверхности металлов внесли Б. Бент и Ф. Заера. Эти авторы предприняли попытку создать механизмы поведения различных углеводородов и их производных на поверхностях d-металлов. Одним из таких исследований является реакция иодометана с поверхностью Cu (111). Иодометан адсорбируется на поверхности меди при 110 К. При 140 К образуются метильные радикалы, наличие которых фиксируется масс-спектрометрическими методами. Также было показано, что реакция может сопровождаться как уходом метильных радикалов с поверхности меди, так и образованием хемосорбированных метильных групп:
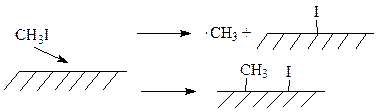
Образование хемосорбированных метильных групп также может осуществляться двумя способами:
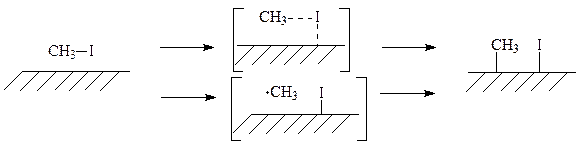
Полученные системы устойчивы даже при температуре 400 К. Хемосорбированные метильные группы десорбируются с поверхности меди при температуре 470 К в виде метильных радикалов или продуктов рекомбинации и диспропорционирования метильных радикалов: CH4, C2H4, C2H6, C3H6:
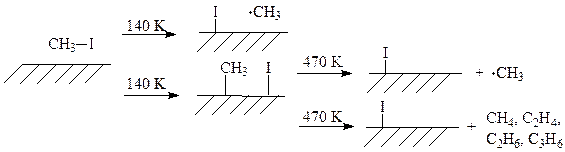
Аналогично реагируют с метилгалогенидами другие 3d-металлы. На рис. 2 показаны элементарные реакции хемосорбированных на поверхностях различных 3d-металлов метильных групп:
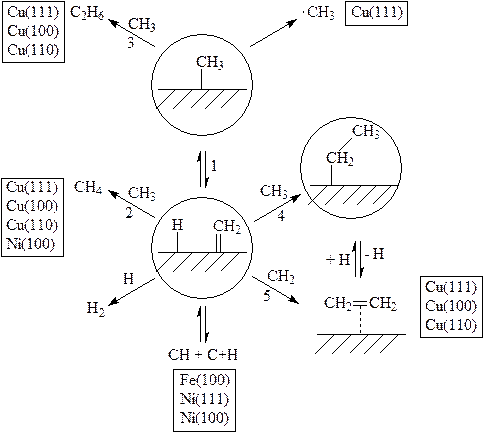
Рис. 2. Превращения метильных групп на поверхности металла.
1) Отделение Н с образованием СH2 – группы. 2) Присоединение Н с образованием СH4. 3) Рекомбинация ×СH3 с СH3 – группой. 4) Рекомбинация ×СH3 с СH2 – группой. 5) Образование этилена. На рисунке не показано сдваивание СН–групп на поверхности Ni (111) с образованием ацетилена [61] и реакция СH2 – групп с СH2СH3, на поверхности Сu (100) c образованием пропила и пропена [53]. Представленные процессы преимущественно протекают на поверхностях металлов, указанных в прямоугольниках.
Наличие адсорбированных на поверхности меди метильных и метиленовых групп обуславливает удлинение углеводородной цепи:
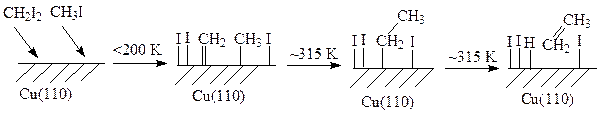
Оказалось, что реакция на поверхности меди зависит от геометрии поверхности. Так, удлинение цепи на Cu (100) осуществляется в 100 раз быстрее, чем на Cu (110) из-за медленной диффузии метиленовых групп к активным центрам поверхности. Максимальная скорость реакции на поверхности Cu (100) достигается примерно при 220 К тогда как на поверхности Cu (110) – при 290-300 К.
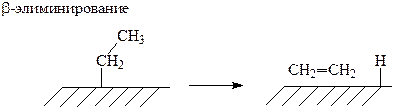
Более сложные алкилиодиды реагируют с 3d-металлами аналогично иодометану, но приводят к образованию более сложных продуктов, т. к. имеет место рекомбинация и диспропорционирование радикалов и другие реакции. Кроме того, при образовании адсорбированных алкильных групп наблюдается a– и b–гидридное элиминирование:
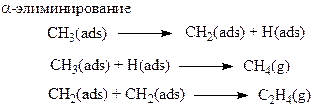
Прочность связи металл – алкил при β-гидридном элиминировании алкильных групп с поверхности металла может быть легко определена из простого термодинамического цикла. Например, для расчета прочности связи металл–этил был применен следующий термодинамический цикл:
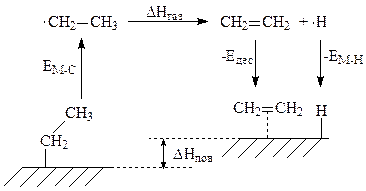
∆Hпов* = ЕМ-С + ∆Нгаз − Едес − ЕМ-Н
Рис.3. Термодинамический цикл для оценки прочности связи металл–алкил (ЕМ-С) для этильных групп на поверхности металлов.
Едес – энергия десобции; EМ-Н – энергия разрыва связи металл-водород.
*Изменение энтальпии β- гидридного элиминирования на поверхности (∆Hпов) определяется для реакции идущей в обоих направлениях.
Превращение 1-иодпропана на Cu (110) при температурах 100-400 К может быть представлено следующей схемой:
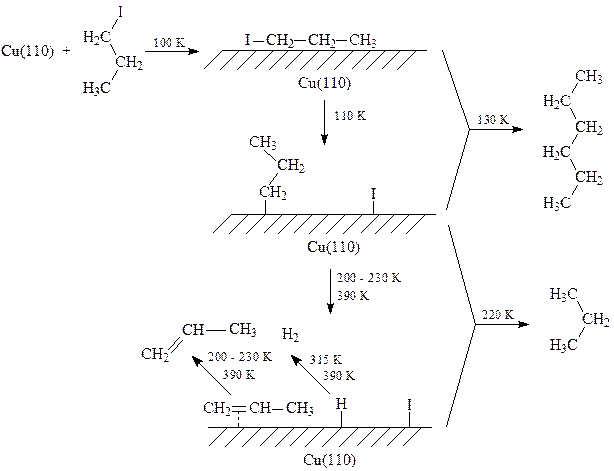
Первой стадией этой реакции является молекулярная адсорбция 1-йодпропана на поверхности металла. При температурах выше 110 К наблюдается диссоциация органического галогенида с образованием пропильных групп, которые сдваиваются при 130 К, и только при температурах выше 200 К наблюдается образование пропана и пропена.
Для пропильных групп соотношение скоростей реакций a– и b–гидридного элиминирования при 300 K на покрытой иодом поверхности Cu (110) составляет ~ 10-10. 1-
На рис. 4 представлены возможные превращения 2-метилпропильных групп на поверхности металлов. Однако, как показывает эксперимент, все представленные на рис. 4 реакции одновременно не реализуются ни на одном из 3d-металлов].
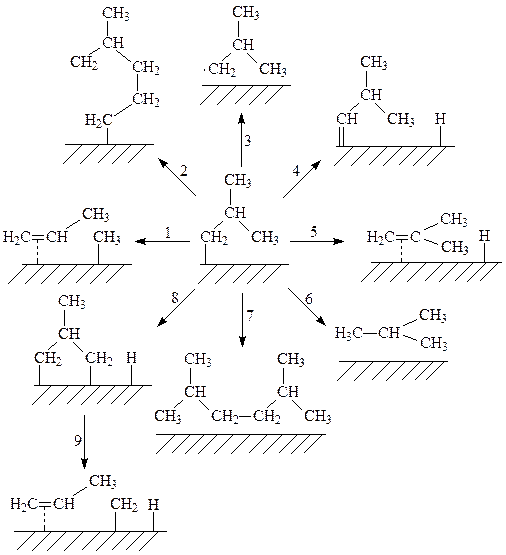
Рис.4. Реакции 2-метилпропильных групп на поверхности металлов.
1. b–алкильное элиминирование. 2. Введение олефина (удлинение цепи).
3. Гомолиз связи М–С.4. α–гидридное элиминирование.
5. b–гидридное элиминирование. 6. Восстановительное элиминирование.
7. Восстановительное сдваивание. 8. γ–гидридное элиминирование.
9. Метатезис.
Аналогичные результаты были получены при термическом разложении 1,6-дийодгексана на поверхности Ni (100). В этом случае, также наблюдается образование металлоцикла, превращение которого, на поверхности металла (согласно стадиям 1-5) приводит к циклогексену, а затем к бензолу. Кроме того, продуктами реакции являются йодгексан, гексан, метилциклопентан. Исследование реакций 1,6-дийодгексана, 6-бром-1-гексена, 1,5-гексадиена, метилциклопентана, метиленциклопентана, 1-метил-1-циклопентена, циклогексана, йодциклогексана и циклогексена с Ni (100) позволило авторам предложить следующую схему образовании продуктов этих реакций:
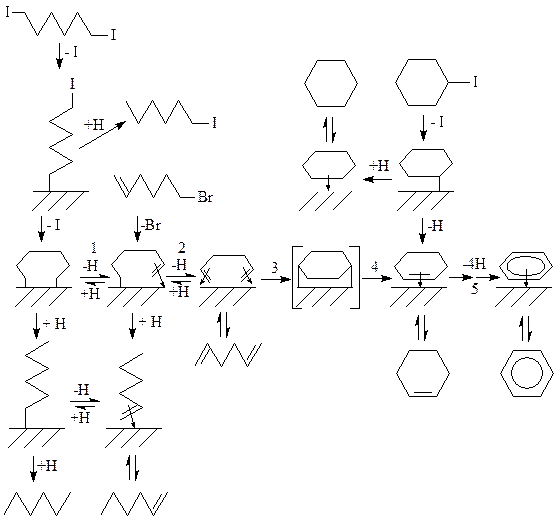
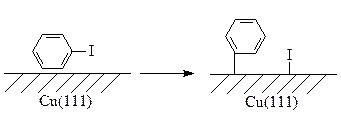
Термическая или электронно-наведенная диссоциация иодбензола на поверхности меди Cu (111) приводит к образованию адсорбированных фенильных групп [101]:
При температурах, ниже 200 К адсорбированные фенильные группы реагируют с иодалканами с образованием соответствующих алкилбензолов. Низкотемпературная (<175 K) стадия включает активное взаимодействие адсорбированных фенильных групп с алкильными радикалами, что позволило авторам предложить использовать адсорбированные фенильные группы в качестве ловушек радикальных интермедиатов на поверхности металлов. Высокотемпературный путь реакции (> 300 К) осуществляется с образованием бифенила путем рекомбинации адсорбированных фенильных групп.
На Cu (100) адсорбированные фенильные группы также были получены диссоциативной адсорбцией иодбензола при 200 К. Реакция с газофазными метильными радикалами осуществляется при 240 К по механизму Или – Ридила, а при 380 К – по механизму Лэнгмюра – Хиншельвуда .
Адсорбированные фенильные группы реагируют с соадсорбированным метилиодидом на поверхности Cu (110) при 315 К по механизму Или – Ридила, а при 426 К – по механизму Лэнгмюра – Хиншельвуда. Авторы [102] считают, что реакция метилиодида с адсорбированными на Cu (100) и Cu (110) фенильными группами осуществляется согласно радикальному механизму.
Реакция Ульмана имеет большое синтетическое значение, поэтому множество работ, посвященных взаимодействию меди с галогензамещенными ароматическими соединениями, связаны с исследованием ее механизма . Наиболее часто ее применяют для иодпроизводных ароматических соединений, реже – для бромопроизводных . Обычно взаимодействие осуществляется при 150-300 оС без растворителя. Более низкие температуры требуют применение диполярных апротонных растворителей (например, ДМФА).
В работе исследован механизм реакции Ульмана в адсорбированных монослоях. При малых степенях покрытия поверхности иодбензол ориентируется параллельно поверхности меди (а). Для больших степеней покрытия поверхности предложена двухслойная адсорбционная модель (б):
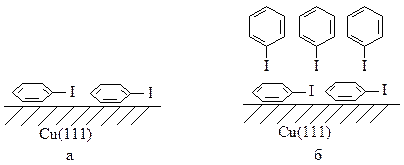
Предложены две схемы механизма реакции. Первая схема осуществляется при низких температурах и высоких степенях покрытия поверхности и включает в себя взаимодействие иодбензола из второго монослоя с адсорбированной фенильной группой:
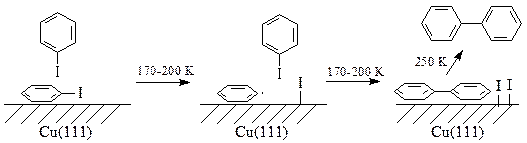
Вторая схема имеет место при высоких температурах и низких степенях покрытиях поверхности, когда адсорбированные фенильные группы сдваиваются:
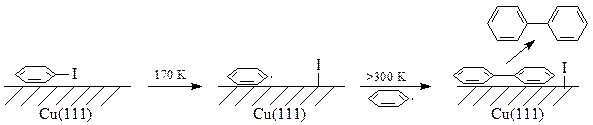
|
из
5.00
|
Обсуждение в статье: На поверхности металлов |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

