 |
Главная |
сканирующей туннельной микроскопии
|
из
5.00
|
В последние годы разработан метод сканирующей туннельной микроскопии позволяющий осуществлять манипуляции отдельных атомов или молекул на различных поверхностях при низких температурах. Райдер с сотрудниками, применяя этот метод, осуществили реакцию Ульмана, состоящую в гомосдваивании двух молекул йодбензола на краю террасы поверхности меди [111]. Полученные в работе [111] результаты (20 К) представлены на рис. 5.
На рис. 5а видно, что йодбензол адсорбируется ароматическим кольцом приблизительно параллельно поверхности меди (111) с помощью взаимодействия его π-электронов кольца с металлом, что приводит к его закреплению на краю террасы. При действии импульсов напряжением 1,5V наблюдается последовательное отщепление радикалов йода от адсорбированных молекул йодбензола (рис. 5b и рис. 5c). При этом никакого расщепления связей С–Н или С–С не наблюдалось, так как энергии разрыва этих связей значительно больше связи С–J. После диссоциации молекул йодбензола радикалы во всех случаях перемещались на одинаковые расстояния. Удаление атома иода к другому участку террасы осуществляли боковой манипуляцией (рис. 5d). Также боковой манипуляцией проводили сближение двух фенильных радикалов (рис. 5e). Рекомбинацию фенильных радикалов инициировали воздействием импульса электрического тока напряжением 0,5 V.
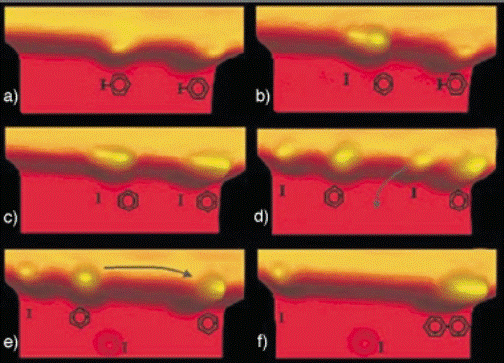
Рис. 5. Изображения STM поверхности во время реакция Ульмана:
a) Адсорбция двух молекул йодбензола на краю террасы поверхности меди (111). b), c) Последовательное отщепление двух атомов йода импульсами напряжения 1,5 V.d) Удаление атома йода. e) Сближение фенильных радикалов. f) Образование связи Ph–Ph с помощью импульса напряжения 0,5 V.
Полученные результаты позволяют предположить, что образующиеся при диссоциации йодбензола фенильные радикалы адсорбируются только на определенных центрах поверхности меди, а их рекомбинация протекает на поверхности металла .
4.2.3. Особенности исследование кинетических закономерностей реакции
3d-металлов и магния с бензилгалогенидами в диполярных апротонных
растворителях
Выбор метода исследования
Метод отбора проб. Первые работы по исследованию реакции магния с органическими галогенидами относятся еще к 1937 году. С тех пор многие авторы исследовали кинетику этой реакции методом отбора проб. Однако, этот метод имеет большую систематическую ошибку, которую никто из исследователей не учитывал. Случайные ошибки экспериментов (часто более 10%) авторы до сих пор определяют без применения коэффициента Стьюдента, поэтому реально эти ошибки составляют 25-30%.
Поэтому метод отбора проб часто бывает не применим для исследования кинетики реакции магния и 3d-металлов с бензилгалогенидами в ДАР.
Термокинетический (калориметрический) метод. При изучении кинетики химических реакций в настоящее время наиболее широко применяются физико-химические методы исследования, которые позволяют определить изменение концентрации одного из веществ, участвующих в реакции или продуктов их взаимодействия, функционально связанное с каким-либо физико-химическим параметром системы. Как известно, любая химическая реакция или физико-химический процесс сопровождаются поглощением или выделением тепла, поэтому возможно исследование кинетики реакции методом калориметрии. Ограничения связаны только с небольшой группой атермических процессов, мольные энтальпии которых достаточно близки.
Для изучения реакций в растворах широкое применение нашли упрощенные установки с автоматизированной записью изменения температуры образца во времени. Для исследования кинетики образования реагента Гриньяра нами была создана установка, позволяющая регистрировать изменение температуры во времени с высокой линейностью при быстродействии менее 1 секунды, что дало возможность рассчитать текущие концентрации образовавшегося реагента Гриньяра с высокой точностью и достоверностью. Ниже представлены кинетические кривые для реакции бензилхлорида с магнием в диэтиловом эфире полученные этим методом.
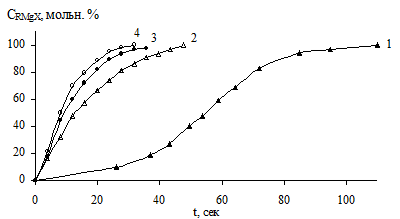
Рис. 14. Кинетические кривые реакции магния с бензилхлоридом в ДЭЭ.
Кривая 1 получена при реакции первой порции бензилхлорида с магнием в ДЭЭ (концентрация бензилхлорида 0,1 М). Она представляет собой S-образную кривую, которая не подчиняется уравнениям первого порядка. Добавление новых порций бензилхлорида изменяет вид кинетических кривых (2 – 4). Эти кривые подчиняются уравнениям первого порядка (с большой ошибкой), но индукционный период полностью не элиминируется. При добавлении нескольких новых порций бензилхлорида наблюдается ограничение скорости реакции, несмотря на то, что реакция протекает в кинетической области. Аналогичное наблюдение при исследовании реакции бутилбромида с магнием было сделано авторами работ, которые предположили, что образующийся реагент Гриньяра является катализатором этого процесса. Однако, исследования кинетики различных гетерогенных реакций твердое тело-жидкость убедительно доказали, что увеличение скорости процесса в этом случае связано не с автокатализом, а со вступлением в реакцию всей поверхности образца.
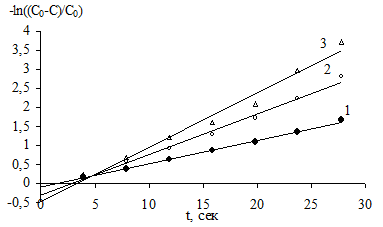
Рис. 15. Зависимость – ln((C0–С)/C0) от времени для реакции магния с бензилхлоридом в ДЭЭ. Номера кривых соответствуют номерам на рис. 14.
Скорость реакции образования бензилмагнийхлорида может быть формально описана выражением:
V = K×[S]×[RX]×[SolvH]
где: K – константа скорости реакции третьего порядка; [S] – площадь поверхности магния; [RX] и [SolvH] – соответственно концентрации бензилгалогенида и сольватирующего растворителя.
Полученное выражение применимо только при низких концентрациях бензилгалогенида (примерно до 0,3М). При увеличении концентрации бензилгалогенида более 0,25М сильно возрастает ошибка определения скорости процесса. При концентрации бензилгалогенида 2М реальная скорость процесса значительно ниже скорости, рассчитанной по предложенному выражению. Анализ работ позволяет предположить, что кажущийся порядок реакции зависет от концентрации органического галогенида и, возможно, от концентрации сольватирующего растворителя! то есть, формулы формальной кинетики для гомогенных реакций для описания гетерогенных реакций применять нельзя!
Полученные кинетические кривые начинаются не из начала координат, даже при вступлении в реакцию всей поверхности образца. Отсекаемый участок времени не является индукционным периодом реакции. Его продолжительность увеличивается с увеличением концентрации бензилгалогенида. Эти факты свидетельствуют, что реальный порядок реакции по бензилгалогениду не равен 1 и при создании математической модели, описывающей процесс в широком диапазоне концентраций органического галогенида, необходимо учитывать адсорбцию и реагента и растворителя на поверхности металла .
Резистометрический метод. Резистометрический метод обладает очень высокой чувствительностью, хорошей точностью и воспроизводимостью результатов в широком диапазоне температур и исходных концентраций реагентов. Важными преимуществами метода являются возможность непрерывной записи кинетических кривых и поступление информации в виде простой физической величины, что дает возможность оцифровки полученной информации, небольшие количества исходных соединений и растворителя, применяемые в ходе исследования кинетики. Кроме того, метод позволяет выделить стадии, которые осуществляются на поверхности металла, что очень важно при исследовании кинетики гетерогенных реакций.
Для исследования кинетики реакций 3d-металлов и магния с органическими галогенидами бензильного типа в диполярных апротонных растворителях мы выбрали именно этот метод и создали установку, аналогичную представленной в. В качестве измерительного моста применяли универсальный прибор для измерения и поверки (УПИП-60М), позволяющий измерять низкие сопротивления (до 10-6 ом) по четырехпроводной схеме с высокой точностью (класс точности 0,05 или 0,1 в зависимости от диапазона), независимо от длины соединяющих проводов. Сигнал УПИП-60М, преобразованный в цифровой код с помощью 12-разрядного интерфейса RS-232A, поступал на персональный компьютер. Для визуального контроля времени применяли электронный цифровой секундомер СЭЦ-100 (класс точности 0,1). Отдельные измерения проводили цифровым миллиомметром GOM-802 (Good Will Instruments Co, Taiwan) подсоединенным к персональному компьютеру (класс точности 0,03). Для примера на рис. 16 для реакции меди с тетрахлоридом углерода ДМАА изображены зависимости скорости растворения металла от начальных концентраций компонентов смеси , которые имеют вид, характерный для реакций, протекающих по механизму Лэнгмюра – Хиншельвуда или Или – Ридила.
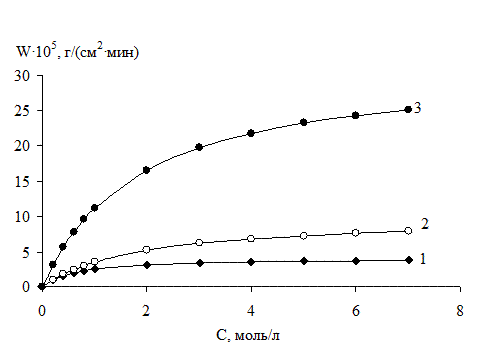
Рис. 16. Зависимости скорости (w) реакции меди с тетрахлоридом углерода в ДМАА от исходных концентраций компонентов смеси при 313 К. Индифферентный растворитель (нонан – п-ксилол 1:1 по объему):
1. СCCl4 = 0,2 моль×л-1; СДМАА изменяли от 0 моль×л-1 до 7,0 моль×л-1.
2. СДМАА= 0,2 моль×л-1; СCCl4 изменяли от 0 моль×л-1 до 7,0 моль×л-1.
3. СДМАА= 2 моль/л-1; СCCl4 изменяли от 0 моль×л-1 до 7,0 моль×л-1.
Если адсорбция реагента и растворителя осуществляется на различных активных центрах поверхности металла, то схема Лэнгмюра –Хиншельвуда имеет вид:
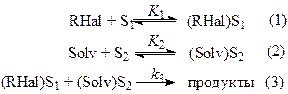
Где: SolvH – ДМФА, ДМАА, ДМСО и ГМФТА; RHal – тетрахлорид углерода или органический галогенид; K1 и K2 – константы равновесия адсорбции тетрахлорида углерода и растворителя соответственно, k3 – константа скорости химического процесса, S1 и S2 – активные центры на поверхности металла.
Природа этих центров полностью не выяснена, однако, вследствие неоднородности поверхности металла, на ней существуют зоны, различающиеся по геометрии и энергии. Скорости реакций этих зон с одним и тем же реагентом различны. Например, известно, что скорость удлинения углеродной цепи на грани Cu (111) в сто раз больше скорости реакции на грани Cu (110).
В кинетическое уравнение, в этом случае, входят степени покрытия поверхности, получаемые из изотермы Лэнгмюра для адсорбции каждого компонента, и выражение для скорости w имеет следующий вид:
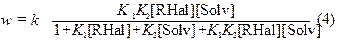
k = k 3 · N1· N2, N1 и N2 – число активных центров поверхности металла, на которых осуществляется адсорбция CCl4 и ДАР соответственно.
Если молекулы органического галогенида (RHal) и растворителя (Solv), равновесно адсорбируются на одинаковых активных центрах (S), а их взаимодействие c поверхностью металла является необратимым процессом, в результате которого непосредственно образуются интермедиаты или продукты реакции. В этом случае можно предложить следующую схему механизма реакции:
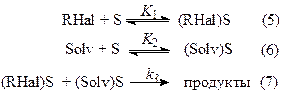
k3 – константа скорости химического процесса; K1 и K2 – константы равновесия адсорбции реагента и растворителя соответственно. Выражение для скорости w имеет следующий вид:
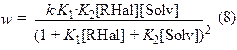
k = k3×N2, N– число активных центров адсорбции на поверхности.
Если процесс протекает на одинаковых центрах адсорбции через равновесное образование поверхностно-связанных промежуточных соединений, то:
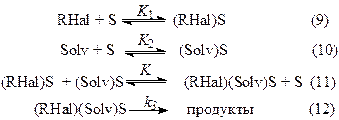
K –константа равновесия образования поверхностно-связанного комплекса. Выражение для скорости процесса имеет вид:
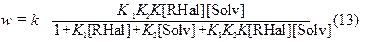
где k=k3·N, N– число активных центров поверхности металла, на которых осуществляется адсорбция органического галогенида и диполярного апротонного растворителя соответственно.
Механизм Или – Ридила предполагает, что равновесно адсорбированная на поверхности металла молекула реагента реагирует с металлом при подходе к ней из раствора молекулы координирующего растворителя. В этом случае возможны две схемы механизма процесса.
А) На поверхности металла адсорбированы только молекулы реагента:
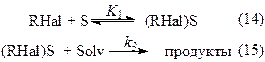
Скорость процесса выражается следующим соотношением:
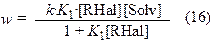
k = k3×N, N– число активных центров адсорбции на поверхности металла.
Б) Молекулы растворителя также адсорбируются на поверхности металла:
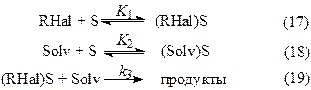
В этом случае уравнение для скорости процесса имеет вид:
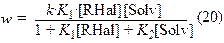
k = k3×N, N– число активных центров адсорбции на поверхности металла.
Увеличение концентрации ДМАА от 0,2 до 2М не изменяет вида зависимости скорости реакции от концентрации тетрахлорида углерода. Кинетические кривые для реакции меди с тетрахлоридом углерода в ДМФА, ДМСО и ГМФТА имеют аналогичный характер, что свидетельствует о протекании процесса по схеме Лэнгмюра – Хиншельвуда (1-3) или (9-12). Обработка полученных экспериментальных зависимостей в рамках уравнений (1-3) и (9-12) по разработанному алгоритму позволила определить константы равновесия адсорбции тетрахлорида углерода и диполярного апротонного растворителя ДМФА, ДМАА, ДМСО и ГМФТА на поверхности металла (K1 и K2) и константу k химического процесса, а также константу K стадии (11). Во всех случаях константа K оказалась равной единице с точностью до ошибки. Это позволило исключить механизм (9-12) из рассмотрения. Исследование кинетики реакции при различных температурах дало возможность определить Еа химического процесса, а также энтальпии и энтропии адсорбции реагентов на поверхности меди
Таблица 41.
Некоторые кинетические и термодинамические параметры реакции
меди с тетрахлоридом углерода в некоторых ДАР
| Параметр процесса | Растворитель | |||
| ДМФА | ДМАА | ДМСО | ГМФТА | |
| Ea, Дж/моль | 79800±600 | 76600±600 | 76200±700 | 90900±700 |
| ΔНоCCl4, Дж/моль | – 4100±300 | – 4000±200 | – 4100±100 | – 4400±300 |
| ΔНоSolvH, Дж/моль | – 27300±200 | – 33100±300 | – 46500±500 | – 20100±700 |
| ΔSоCCl4, Дж/(моль×К) | – 16,9±0,9 | – 17,9±0,7 | – 19,0±0,7 | – 21,3±1,0 |
| ΔSоSolvH, Дж/(моль×К) | – 87,1±0,7 | – 102,3±0,3 | – 126,7±2,2 | – 70,5±2,3 |
Как следовало ожидать, при независимой адсорбции реагента и растворителя на поверхности металла, константы равновесия и энтальпии адсорбции тетрахлорида углерода остаются практически неизменными во всех исследованных растворителях ДМФА, ДМАА, ДМСО и ГМФТА в то время как соответствующие величины для диполярного апротонного растворителя ДМФА, ДМАА, ДМСО и ГМФТА изменяются сильно. Это свидетельствует об избирательном характере адсорбции участвующего в реакции диполярного апротонного растворителя ДМФА, ДМАА, ДМСО и ГМФТА на поверхности меди.
На кривых зависимости скорости реакции всех 3d-металлов и магния с бензилхлоридом или бензилбромидом в ДМФА от концентрации компонентов смеси наблюдаются максимумы. Вид кривых неизменяется при изменении концентрации второго компонента окисляющей смеси или при изменении температуры реакции.
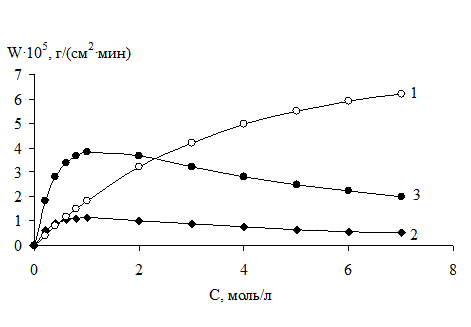
Рис. 18. Зависимости скорости (w) реакции Mn(0) с бензилбромидом в ДМФА от исходных концентраций компонентов смеси при 353 К в присутствии индифферентного растворителя (бензола):
1 – СRHal = 0,5 моль×л-1; СДМФА изменяли от 0 моль×л-1 до 7,0 моль×л-1.
2 – СДМФА= 0,5 моль×л-1; СRHal изменяли от 0 моль×л-1 до 7,0 моль×л-1.
3 – СДМФА= 2 моль/л-1; СRHal изменяли от 0 моль×л-1 до 7,0 моль×л-1.
Это позволяет утверждать, что данные процессы осуществляются по механизму Лэнгмюра – Хиншельвуда, при адсорбции соответствующего бензилгалогенида и ДМФА на одинаковых активных центрах поверхности металла, причем механизм реакции при изменении условий проведения процесса не изменяется. Взаимодействие бензилхлорида или бензилбромида и ДМФА c поверхностью металлов является необратимым процессом, в результате которого непосредственно образуются интермедиаты или продукты реакции (уравнения 5-8).
Таким образом, корректное установление механизмов образования продуктов реакций углеводородов и их производных с на поверхностях d-металлов позволяет в будущем создать различные химически чистые каталитические промышленные процессы получения разнообразных ценных соединений.
|
из
5.00
|
Обсуждение в статье: сканирующей туннельной микроскопии |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

