 |
Главная |
Правила составления тестовых заданий
|
из
5.00
|
1. Начинайте формулировать вопрос с правильного ответа.
2. Содержание задания должно отвечать программным требованиям и отражать содержание обучения.
3. Вопрос должен содержать одну законченную мысль.
4. При составлении вопросов следует особенно внимательно использовать слова "иногда", "часто", "всегда", "все", "никогда".
5. Вопрос должен быть четко сформулирован, избегая слова большой, небольшой, малый, много, мало, меньше, больше и т.д.
6. Избегайте вводных фраз и предложений, имеющих мало связи с основной мыслью, не следует прибегать к пространным утверждениям, так как они приводят к правильному ответу, даже если учащийся его не знает.
7. Неправильные ответы должны быть разумны, умело подобраны, не должно быть явных неточностей, подсказок.
8. Не задавайте вопросы с подвохом (в заблуждение могут быть введены наиболее способные учащиеся).
9. Все варианты ответов должны быть грамматически согласованы с основной частью задания, используйте короткие, простые предложения, без зависимых или независимых оборотов.
10.Реже используйте отрицание в основной части, избегайте двойных отрицаний, таких как: "Почему нельзя не делать…?"
11.Ответ на поставленный вопрос не должен зависеть от предыдущих ответов.
12.Правильные и неправильные ответы должны быть однозначны по содержанию, структуре и общему количеству слов. Применяйте правдоподобные ошибочные варианты, взятые из опыта.
13.Если ставится вопрос количественного характера, ответы располагайте по возрастанию, если дистракторы представлены в виде слов текста, располагайте их в алфавитном порядке.
14.Лучше не использовать варианты ответов "ни один из перечисленных" и "все перечисленные".
15.Избегайте повторения.
16.Используйте ограничения в самом вопросе.
17.Не упрощайте вопросы.
18.Место правильного ответа должно быть определено так, чтобы оно не повторялось от вопроса к вопросу, не было закономерностей, а давалось в случайном порядке.
19.Лучше использовать длинный вопрос и короткий ответ.
20.Проанализируйте задания с точки зрения неверного ответа наиболее подготовленных учеников.
21.Национальные системы ряда стран ставят специфические требования к тестовым заданиям, на которые у нас пока обращается недостаточно внимания [4].
ГЛАВА II. СОСТОЯНИЕ ИЗУЧАЕМОГО ВОПРОСА В СОВРЕМЕННОЙ РОССИЙСКОЙ ШКОЛЕ
Непредельные углеводороды изучаются путем постоянного сравнения по строению и свойствам с предельными углеводородами.
При изучении данного раздела в занятия включается ученический эксперимент. Это осуществляется как на индуктивном, так и дедуктивном пути познания в виде лабораторных опытов или же практических занятий [3].
План изучения темы
1. Понятие непредельных углеводородов
2. Этилен, его строение
3. Строение и номенклатура углеводородов ряда этилена
4. Химические свойства, правило Марковникова
5. Применение и получение этиленовых углеводородов
6. Диеновые углеводороды, строение и химические свойства
7. Ацетилен, строение, химические свойства и применение
Преподавание темы «Непредельные углеводороды» начинается с 10 класса, первого полугодия.
При изучении этой темы пользуются учебником химии под редакцией Г. Е. Рудзитис, Ф.Г. Фельдман, также учебником за 10 класс под редакцией Н. С. Ахметова.
Дидактическим материалом служит книга по химии для 10 классов под редакцией А. М. Радецкого, В. П. Горшкова; используются задания для самостоятельной роботы по химии за 10 класс под редакцией Р. П. Суровцева, С. В. Софронова; используется сборник задач по химии для средней школы и для поступающих в вузы под редакцией Г. П. Хомченко, И. Г. Хомченко. В 10 классе на изучение закономерностей протекания химических реакции отводится 2ч[2,3].
Алкены
Свойства алкенов
Физические свойства алкенов закономерно изменяются в гомологическом ряду: от С2Н4 до С4Н8 – газы, начиная с С5Н10 – жидкости, с С18Н36 – твердые вещества. Алкены практически нерастворимы в воде, но хорошо растворяются в органических растворителях.
Химические свойства алкенов определяются строением и свойствами двойной связи С=С, которая значительно активнее других связей в молекулах этих соединений. Алкены химически более активны, чем алканы.
Характеристики углерод-углеродных связей:

| Е+ (энергия двойной связи) С=С ( + ) | 620 кДж/моль |
| Е (энергия -связи) С-С | 348 кДж/моль |
| Отсюда Е (энергия -связи) | 272 кДж/моль, |
| т.е. Е на 76 кДж/моль меньше Е. |
Получение алкенов
В природе алкены встречаются в значительно меньшей степени, чем предельные углеводороды, по-видимому, вследствие своей высокой реакционной способности. Поэтому их получают с использованием различных реакций.
I. Крекинг алканов:

Например:

II. Отщепление (элиминирование) двух атомов или групп атомов от соседних атомов углерода с образованием между ними -связи.
1. Дегидрогалогенирование моногалогеналканов при действии спиртового раствора щелочи
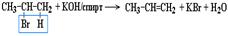
2. Дегидратация спиртов при температуре менее 150C в присутствии водоотнимающих реагентов

Реакции элиминирования идут в соответствии с правилом Зайцева:
Отщепление атома водорода в реакциях дегидрогалогенирования и дегидратации происходит преимущественно от наименее гидрогенизированного атома углерода.
Современная формулировка: реакции отщепления идут с образованием более замещенных при двойной связи алкенов.
Такие алкены обладают более низкой энергией.

3. Дегалогенирование дигалогеналканов, имеющих атомы галогена у соседних атомов углерода, при действии активных металлов :

4. Дегидрирование алканов при 500С:

Применение алкенов
Алкены применяются в качестве исходных продуктов в производстве полимерных материалов (пластмасс, каучуков, пленок) и других органических веществ.
Этилен (этен) Н2С=СН2 используется для получения полиэтилена, политетрафторэтилена (тефлона), этилового спирта, уксусного альдегида, галогенопроизводных и многих других органических соединений.

Применяется как средство для ускоренного созревания фруктов.
Пропилен (пропен) Н2С=СН2–СН3 и бутилены (бутен-1 и бутен-2) используются для получения спиртов и полимеров.
Изобутилен (2-метилпропен) Н2С=С(СН3)2 применяется в производстве синтетического каучука.
Алкадиены
Алкадиены (диены) – непредельные алифатические углеводороды, молекулы которых содержат две двойные связи. Общая формула алкадиенов СnH2n-2.
Свойства алкадиенов в значительной степени зависят от взаимного расположения двойных связей в их молекулах. По этому признаку различают три типа двойных связей в диенах.
1.Изолированные двойные связи разделены в цепи двумя или более -связями:
СН2=СН–СН2–СН=СН2
Разделенные sp3-атомами углерода, такие двойные связи не оказывают друг на друга взаимного влияния и вступают в те же реакции, что и двойная связь в алкенах.
Таким образом, алкадиены этого типа проявляют химические свойства, характерные для алкенов.
2. Кумулированные двойные связи расположены у одного атома углерода:
СН2=С=СН2 (аллен)
Подобные диены (аллены) относятся к довольно редкому типу соединений.
3.Сопряженные двойные связи разделены одной -связью:
СН2=СН–СН=СН2
Сопряженные диены представляют наибольший интерес. Они отличаются характерными свойствами, обусловленными электронным строением молекул, а именно, непрерывной последовательностью 4-х sp2-атомов углерода. Отдельные представители этих диенов широко используются в производстве синтетических каучуков и различных органических веществ.
Получение алкадиенов
Общие способы получения диенов аналогичны способам получения алкенов.
1. Каталитическое двухстадийное дегидрирование алканов (через стадию образования алкенов). Этим путем получают в промышленности дивинил из бутана, содержащегося в газах нефтепереработки и в попутных газах:

Каталитическим дегидрированием изопентана (2-метилбутана) получают изопрен:

2. Синтез дивинила по Лебедеву:

3. Дегидратация гликолей (двухатомных спиртов, или алкандиолов):
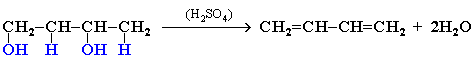
4. Действие спиртового раствора щелочи на дигалогеналканы:
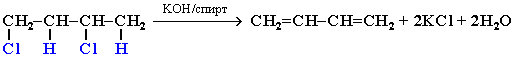
Алкины
Свойства алкинов
Физические свойства. Температуры кипения и плавления ацетиленовых углеводородов увеличиваются с ростом их молекулярной массы. При обычных условиях алкины С2Н2-С4Н6 – газы, С5Н8-С16Н30 – жидкости, с С17Н32 – твердые вещества. Температуры кипения и плавления алкинов выше, чем у соответствующих алкенов (табл.6.4.1).
Таблица 6.4.1. Физические свойства алкенов и алкинов

Алкины плохо растворимы в воде, лучше – в органических растворителях.
Химические свойства алкинов сходны с алкенами, что обусловлено их ненасыщенностью.
Характеристики связей в алкинах:

|
из
5.00
|
Обсуждение в статье: Правила составления тестовых заданий |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

