 |
Главная |
Практическое занятие № 3
|
из
5.00
|
Тема. Решение задач по теме «Непредельные углеводороды».
Цели:
· закрепить полученные ранее теоретические представления о типах химических реакций, механизмах их протекания на примере химических свойств алкенов, алкинов, диеновых углеводородов;
· развивать навыки составления названий веществ, структурных формул изомеров.
Ход работы
Основные задания
1. Перечислите типы реакций, характерные для этиленовых и ацетиленовых углеводородов.
2. Допишите уравнения реакций:
2.1. 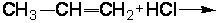
2.2. 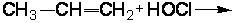
2.3. 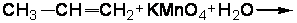
2.4. 
2.5. 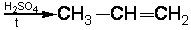
2.6. 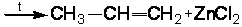
3. Объясните, почему при гидрогалогенировании пентадиена-1,3 получается смесь галогенпроизводных.
4. Приведите уравнения реакций, с помощью которых можно осуществить превращения:
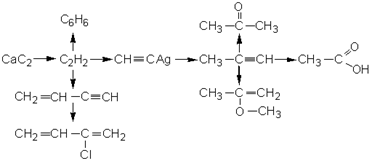
5. В четырех пробирках находятся жидкости: четыреххлористый углерод, гексан, гексен-1 и гексин-1. Как определить, какое из веществ находится в каждой пробирке? Приведите уравнения реакций.
Дополнительные задания
1. Дайте названия соединениям:
1.1. 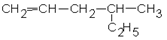
| 1.6. 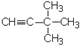
|
1.2. 
| 1.7. 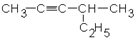
|
1.3. 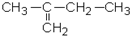
| 1.8. 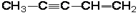
|
1.4. 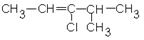
| 1.9. 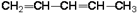
|
1.5. 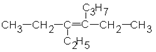
| 1.10. 
|
2. Укажите, для каких из них характерна геометрическая изомерия. Приведите структурные формулы цис- и транс-изомеров.
3. Приведите механизм реакции гидратации бутена-1.
4. Приведите уравнения реакций, с помощью которых можно осуществить превращения:→
3.1. этанол → бутадиен-1,3 → бутадиеновый каучук
3.2. 2-метилбутан → изопрен → цис-полиизопрен
ГЛАВА IV . ТЕСТЫ И ЗАДАЧИ ПО ТЕМЕ «НЕПРЕДЕЛЬНЫЕ УГЛЕВОДОРОДЫ»
Задачи
1. При пропускании 11,2 л (н.у.) смеси этана, этилена и ацетилена через склянку с бромной водой масса склянки увеличилась на 10,9 г. При пропускании исходной смеси через сосуд с аммиачным раствором оксида серебра масса сосуда увеличилась на 3,9 г. Определите состав газовой смеси (в % по объему).
2.Этилен, образовавшийся при дегидратации этанола (массовая доля выхода 75%) пропустили через раствор перманганата калия. Масса раствора увеличилась на 5,6 г. Сколько спирта (г) было затрачено на получение этилена?
3. Составьте структурные формулы соединений по их названиям:
а) 2 – метилбутен – 1; б) пентен – 2; в) 3 – метилпентен – 1; г) пропин.
Какие из них являются изомерами и почему?
4.Составьте схемы реакций полимеризации этилена и пропилена.Какие продукты при этом образуются и каковы их области применения?
5. С помощью каких характерных реакций можно отличить ацетилен от этана? Напишите соответствующие уравнения реакций.
6. Какой объем воздуха ( н. у.) потребуется для полного сжигания 5 л этилена? Объемная доля кислорода в воздухе составляет 21 %.
7. Неизвестный алкин массой 8 г в реакции с избытком брома образует продукт массой
72 г. Название этого алкина по систематической номенклатуре.
8. Неизвестный алкен присоединил 0,36 г воды, при этом образовался 1,2 г продукта реакции, название этого алкена по систематической номенклатуре.
Тесты
1.Какие из утверждений являются верными?
А) Органические вещества нельзя получить из неорганических.
Б) Свойства веществ зависят не только от состава, но и от строения.
2. π-связь есть в молекуле:
1) пропана;
2) 2-метилпропана;
3) пропилена;
4) циклобутана.
3. Пространственная конфигурация электронных облаков атома углерода в состояниях sp- и sp3 – гибридизации соответственно:
1) линейная, тетраэдрическая;
2) линейная, треугольная;
3) тетраэдрическая, треугольная;
4) треугольная, линейная.
4.В виде цис- и транс-изомеров может существовать:
1) 2-метилпропен;
2) бутен-1;
3) гексен-1;
4) 1,4-дихлорбутен-2.
5.Реакция, при которой происходит перегруппировка атомов, называется реакцией:
1) элиминирования;
2) изомеризации;
3) полимеризации;
4) поликонденсации.
6. Только первичные и вторичные атомы углерода имеются в соединении, название которого:
1) 2,2 –диметилбутан;
2) 2,2- диметилпропан;
3) бутен-2;
4) этан.
7.Продуктом взаимодействия пентена-1 с хлороводородом является:
1) 1-хлорпентан;
2) 1-хлорпентен-2;
3) 2-хлорпентан;
4) 1,2-дихлорпентан.
9.В результате следующей цепочки превращений:
СаС2 —+Н2О →Х1 —to, Cакт→ Х2—FeCl3, +Cl2→Х3
образуется конечный продукт Х3, название которого _______________
10. π-связи нет в молекуле:
1) циклогексана;
2) ацетилена;
3) бутадиена-1,3;
4) этена.
11. Пространственная конфигурация электронных облаков атома углерода в состояниях sp2- и sp3 – гибридизации соответственно:
1) треугольная, линейная
2) треугольная, тетраэдрическая;
3) линейная, тетраэдрическая;
4) тетраэдрическая, линейная.
12. В виде цис- и транс-изомеров может существовать:
1) 2-метилбутен-2;
2) 2-метилпентен-2;
3) 2,3-дибромбутен-1;
4) 1-бром-2-хлорэтен.
13. Реакция, в которой происходит присоединение воды, называется реакцией:
1) гидрирования;
2) гидратации;
3) дегидрирования;
4) дегидратации.
14. Продуктом взаимодействия бутена-1 с водой является:
1) бутанол-2;
2) бутадиен-1,3;
3) ацетальдегид;
4) винилацетилен.
15. В результате риформинга протекает реакция:
1) гидрирования;
2) гидратации;
3) дегидрирования;
4) присоединения.
16.В результате следующей цепочки превращений: СН3Сl—+Na, to→ Х1—кат., to →Х2—полимеризация→Х3 образуется конечный продукт Х3 , название которого ________________.
(Запишите слово в именительном падеже).
17. Как изменяется массовая доля углерода в алкенах с ростом значения молярной массы?
а) возрастает
б) уменьшается
в) не изменяется
г) изменяется случайным образом
18. Бромэтан может быть превращен в этилен:
а) взаимодействием с натрием
б) взаимодействием со щелочным раствором щелочи
в) нагреванием с серной кислотой
г) взаимодействием с водородом
19. Укажите значение относительной молекулярной массы для алкена с 6-ю атомами углерода в молекуле:
а) 86
б) 84
в) 82
г) 80
20. Какие реагенты взаимодействуют с этиленом?
а) бромная вода
б) водный раствор перманганата калия
в) кислород
г) вода в присутствии концентрированной серной кислоты
21. Реакция присоединения воды называется реакцией:
а) гидрирования
б) дегидратация
в) гидратации
г) дегидрирования
22. Какие вещества, названия которых приведены ниже, являются между собой гомологами?
а) этен
б) 2- метилпропан
в) 1, 2 дихлорпропен
г) 1- хлорпропен
23. Сколько изомерных алкенов можно получить при дегидрировании 2- метилбутана?
а) 2
б) 1
в) 3
г) 4
24. Укажите названия алкенов, для которых возможна геометрическая изомерия:
а) 1,1 – дихлорэтен
б) 1,2 – дихлорэтен
в) винилхлорид
г) бутен – 2
25. Присоединение каких веществ к алкенам объясняется с помощью правила Марковникова?
а) водород
б) хлороводород
в) вода
г) бром
26. Какие вещества обесцвечивают бромную воду?
а) полиэтилен
б) цис – 2- бутен
в) транс- 2- пентен
г) 2- хлор-2- бутен
27. Реакцией Лебедева называется реакция получения:
а) 1,3 – бутадиена из этилена
б) 1,3 – бутадиена из винилхлорида
в) 1,3- бутадиена из бутана
г) 1,3- бутадиена из этанола
28. Изопрен можно получить при дегидрировании:
а) метана
б) бутана
в) 2- метилбутена
г) 1,3- бутадиена
29. При взаимодействии 1моль водорода и 1моль бутадиена -1,3 преимущественно образуется:
а.) бутан
б) бутен- 1
в) бутен- 2
г) циклобутан
30. В результате вулканизации каучука можно получить:
а) гуттаперчу
б) резину
в) эбонит
г) фенопласт
31. С какими веществами реагирует 1,3- бутадиен?
а) бром
б) водород
в) кислород
г) хлороводород
32. При взаимодействии между собой трех молекул ацетилена в присутствии катализатора при нагревании получается?
а) ацетальдегид
б) винилацетилен
в) винилхлорид
г) бензол
33. По реакции Кучерова получают:
а) из этанола 1,3- бутадиен
б) из ацетилена винилацетилен
в) из ацетилена ацетальдегид
г) из хлорэтана этан
34. В молекуле какого вещества длина связи между атомами углерода наименьшая?
а) пропан
б) этен
в) этин
г) этан
35. В молекуле алкина 8 атомов углерода. Укажите значение молярной массы алкина (г/ моль)
а) 110
б) 112
в) 114
г) 108
36. Пропин можно получить:
а) гидрированием пропена
б) дегидрированием пропена
в) дегидрированием пропана
г) гидрированием одной двойной связи пропадиена
37. Охарактеризуйте тройную связь между атомами углерода
а) короче одинарной, но длинее двойной
б) короче и одинарной, и двойной связи
в) прочнее и одинарной, и двойной связи
г) энергия равна утроенной энергии одинарной связи
38. Как изменяется массовая доля углерода в алкинах с возрастанием молярной массы алкина7
а) уменьшается
б) возрастает
в) не изменяется
39. С каким веществом реагирует как пропан, так и пропин?
а) водородом
б) бромной водой
в) кислородом
г) водой
40. Ацетилен можно получить:
а) восстановлением этилена водородом
б) взаимодействием карбида кальция с водой
в) дегидрированием этана
г) крекингом метана
41. Укажите число изомерных алкинов состава 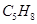
а) 2
б) 3
в) 4
г) 5
42. Как изменяется прочность связи между атомами углерода в ряду этан-этен-этин?
а) уменьшается
б) возрастает
в) не изменяется
г) наиболее слабая в этане, наиболее прочная в этине
43. Ацетилен можно превратить в ацетальдегид реакцией:
а) гидрирования
б) гидратации в присутствии сульфата ртути
в) окисления подкисленным водным раствором перманганата калия
г) горения
44. При окислении этилена водным раствором перманганата калия образуется:
а) уксусная кислота
б) этиленгликоль
в) глицерин
г) водород
45. Алкен можно получить при:
а) при крекинге пентана
б) при взаимодействии 1- хлорпропана со спиртовым раствором гидроксида калия
в) при дегалогенировании 1,2- дихлорэтана
г) при взаимодействии 1 моль пропина с 2 моль водорода
ЛИТЕРАТУРА
1. О. В. Байдалина. О прикладном аспекте химических знаний // Химия в школе, 2005, № 5, с. 45-47.
2.Ахметов Н. С. Учебник для 10класса общеобразовательных учреждений. М.: Просвещение, 1998 г.
3.Рудзитис Г. Е., Фельдман Р. Г. Учебник для 10 класса средней школы. М.: Просвещение, 1992.
4 Майоров А.Н. Теория и практика создания тестов для системы образования. - М., "Интеллект центр", 2001. - 296 с.
5. Деревянкина, С.Е. Клинков, Т.А. Монастырская Вопросы экологии на уроках химии// Химия в школе, 2005, № 1,с.4-7
6.Единый государственный экзамен 2002: Контрольные измерительные материалы: Химия / А. А. Каверина, Д. Ю. Добротин, М. Г. Снастина и др.; М.: Просвещение, 2002. – с. 39 – 51.
7.Химия: Большой справочник для школьников и поступающих в вузы / Е. А. Алферова, Н. С. Ахметов, Н. В. Богомолова и др. М.: Дрофа, 1999. с. 430-438
8.Р. П. Суровцева, С. В. Сафронов. Задания для самостоятельной работы по химии. М.: Просвещение, 1993 г.
9.Борисев М. И. Н., Методика преподавания химии, т. 2, 1954
10.. Несмеянов А. Н., Несмеянов Н.А. «Начала органической химии», т.2, М.:Химия, 1969 - 826 с.
11.Чернобельская Г. М. Методика обучения химии в средней школе: Учеб. для студ. высш. учеб. заведений. — М.: Владос, 2000. — 336 с.
12.О. С. Зайцев. Методика обучения химии: Теоретический и прикладной аспекты. – М.: Гуманит. изд. ВЛАДОС, 1999. – 358 с.
13.Г. П. Хомченко. Пособие по химии для поступающих в вузы. М.: Просвещение, 1999 г. – 228 с.
14. Лидин Р.А. Химия: Руководство к экзаменам / Р.А. Лидин, В.Б. Маргулис. – М.: ООО Издательство «АСТ»: ООО «Издательство Астрель», 2003. 207 с.
|
из
5.00
|
Обсуждение в статье: Практическое занятие № 3 |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

