 |
Главная |
Оксиды и пероксиды металлов IIA группы
|
из
5.00
|
Атомы металлов IIA группы в соединениях двухвалентны. Поэтому общая формула оксидов - MeO и пероксидов - MeO2 (ВеО2 - не получен).
Получение
Оксиды получают при нагревании:
2Me + O2 = 2 MeO,
Me(OH)2 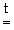 MeO + H2O (Me = Be, Mg)
MeO + H2O (Me = Be, Mg)
MeCO3 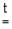 MeO + CO2 (Me = Be, Mg, Ca, Sr)
MeO + CO2 (Me = Be, Mg, Ca, Sr)
2Me(NO3)2 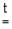 2MeO + 4NO2 + O2
2MeO + 4NO2 + O2
Пероксиды получают по реакции нейтрализации Н2О2:
Me(OH)2 + H2O2 = MeO2 + 2H2O (кроме BaO2),
2BaO + O2 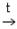 2BaO2.
2BaO2.
Свойства
Оксиды металлов IIA группы являются основными оксидами, а ВеО проявляет амфотерные свойства. Оксиды реагируют с водой:
МеO + H2O = Ме(OH)2 (кроме ВеО),
легко растворяются в кислотах:
MeO + 2HCl = MeCl2 + H2O,
а ВеО взаимодействует и со щелочами:
BeO + 2NaOH 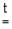 Na2BeO2 + H2O,
Na2BeO2 + H2O,
BeO + 2NaOH + H2O = Na2[Be(OH)4],
BeO + Na2CO3 = Na2BeO2 + CO2.
Пероксиды подвергаются сильному гидролизу:
MeO2 + 2H2O = Me(OH)2 + H2O2,
BaO2 + H2SO4 = BaSO4¯ + H2O2 (в лаборатории),
легко разлагаются кислотами, даже очень слабыми:
MeO2 + H2CO3 = MeCO3 + H2O2.
Пероксиды являются сильными окислителями:
MeO2 + 2NaI + 2H2O ® Me(OH)2 + 2NaOH + I2¯,
но могут и сами окисляться.
Они реагируют с кислотными оксидами и кислотами:
MeO + SO3 = MeSO4,
MeO + 2HNO3 = Me(NO3)2 + H2O.
Гидроксиды
Гидроксиды имеют общую формулу Ме(ОН)2.
Получение
Их получают взаимодействием оксидов Ca, Sr, Ba (Ме) с водой:
MeO + H2O = Me(OH)2.
Be(OH)2 и Mg(OH)2 получают с помощью обменных реакций:
BeГ2 + 2NaOH = 2NaГ + Be(OH)2¯.
Свойства
Гидроксиды щелочноземельных металлов в воде полностью диссоциируют на ионы. Они энергично взаимодействуют с кислотными и амфотерными оксидами и гидроксидами, с многоосновными кислотами могут давать кислые соли:
Cl2 + Ca(OH)2 = Ca(ClO)Cl + H2O
(хлорная известь),
Me(OH)2 + 2HCl = MeCl2 + 2H2O,
2NH4Cl + Me(OH)2 = MeCl2 + 2NH3 + 2H2O,
CuCl2 + Me(OH)2 = Cu(OH)2¯ + MeCl2,
Ca(HCO3)2 + Ca(OH)2 = 2CaCO3¯ + 2H2O,
Ca(OH)2 + CO2 = CaCO3¯ + H2O,
Ba(OH)2 + H2SO4 = BaSO4¯ + 2 H2O.
Все содинения бериллия и растворимые соли бария весьма токсичны.
Известняк и известь применяют в сельском хозяйстве для известкования почв с целью понижения ее кислотности и улучшения структуры. Гипс (CaSO4·2H2O) при нагревании превращается в алебастр (CaSO4·0.5H2O). Они широко используются в строительном деле:.
CaSO4·0,5H2O + 1,5H2O = CaSO4·2H2O.
Катионы кальция и магния обуславливают жесткость воды. При кипячении воды бикарбонаты разлагаются:
Ca(HCO3)2 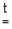 CaCO3¯ + H2O + CO2
CaCO3¯ + H2O + CO2
и образуется накипь, что приводит к взрыву паровых катлов. Для борьбы с карбонатной жесткостью воду подвергают предварительному кипячению либо обрабатывают гашеной известью. Некарбонатная жесткость воды устраняется с помощью соды.
Ca2+ + CO32- = CaCO3¯ ,
Mg2+ + CO32- = MgCO3¯.
Наиболее эффективным способом борьбы с жесткостью воды является применение ионнообменных смол. Важнейший строительный материал - цемент - это силикат и алюмосиликат кальция.
Переходные металлы.
Общая характеристика.
Переходные элементы расположены в Периодической системе в рядах с 4 по 7. Те переходные элементы, символы которых расположены в самой таблице, называют d-переходными элементами, а те элементы, символы которых расположены в низу таблицы, называют лантаноидами и актиноидами или f-переходными элементами. Отстановимся на получении и свойствах соединений элементов Cr, Mn, Fe, Cu, Zn, и Ag. История открытия этих элементов.
Все эти элементы в свободном состоянии - металлы. На внешней электронной оболочке, номер которой совпадает с номером периода, расположены, как правило, два электрона. С ростом заряда ядра (при переходе в ряду слева на право) происходит заполнение d-орбиталей предыдущего электронного слоя. Несмотря на то, что d- и f-электроны расположены во внутреннем электронном слое, они в момент заполнения электронной оболочки могут как валентные электроны участвовать в образовании химической связи.
Электронные конфигурации атомов переходных элементов:
| Cr | 1s22s22p63s23p63d54s1 |
| Mn | 1s22s22p63s23p63d54s2 |
| Fe | 1s22s22p63s23p63d64s2 |
| Cu | 1s22s22p63s23p63d104s1 |
| Zn | 1s22s22p63s23p63d104s2 |
| Ag | 1s22s22p63s23p63d104s24p64d105s1 |
При заполнении электронной оболочки у атома хрома правило Клечковского (минимум энергии атома определяется минимумом суммы квантовых чисел n+l) конкурирует с правилом Хунда (минимуму энергии отвечает максимальный суммарный спин электронов у атома). У Cr победило правило Хунда.
У Zn полностью завершена электронная оболочка внутренних электронных слоев, а на s-подуровне внешнего электронного слоя находятся два электрона, поэтому цинк проявляет в соединениях только одну степень окисления: +2. Незавершенность d-подуровня и один электрон на внешнем s-подуровне указывают на способность химического элемента проявлять в соединениях несколько степеней окисления.
Хром и его соединения
Хром - серебристо-белый с голубоватым оттенком металл, встречается в природе в виде хромита железа Fe(CrO2)2 и хромата свинца PbCrO4.
Получение
Хром получают восстановлением:
Fe(CrO2)2 + 4C = Fe + 2Cr + 4CO,
K2Cr2O7 + 2C = Cr2O3 + K2CO3 + CO,
Cr2O3 + 2Al = 2Cr + Al2O3.
Свойства
Реагирует с неметаллами: галогенами, кислородом и т.д.:
2Cr + 3Г2 = 2CrГ3,
4Cr + 3O2 = 2Cr2O3.
При высокой температуре хром реагирует с водой:
2Cr + 3H2O = Cr2O3 + 3H2,
растворяется в кислотах:
Cr + H2SO4 = CrSO4 + H2
(без доступа воздуха).
Хром не растворяется в концентрированных серной и азотных кислотах на холоде (пассивируется), но растворяется в них при нагревании:
2Cr + 6H2SO4(конц) = Cr2(SO4)3 + 3SO2 + 6H2O.
Применение
Хром используется для получения нержавеющих сталей и различных сплавов, применяется для хромирования изделий.
Соединения хрома со степенью окисления +2
Получение
Эти содеинения получают растворением хрома в кислотах без доступа воздуха:
Cr + 2HCl = CrCl2 + H2 (голубой раствор),
2CrCl3 + H2 = 2CrCl2 + 2HCl,
Cr + CH3COOH = Cr(CH3COO)2 + H2 .
Свойства
Cr(CH3COO)2 + 2NaOH = 2CH3COONa + Cr(OH)2¯ .
Степень окисления: +2 очень неустойчивая и даже кислород воздуха окисляет Cr+2 до Cr+3:
4Cr(OH)2 + O2 + 2H2O = 4Cr(OH)3
(зелено-голубоватый осадок).
При нагревании Cr(OH)2 разлагается.
Соединения хрома со степенью окисления +3
Они напоминают по свойствам соединения Al+3.
Оксид
Оксид получают:
4Cr + 3O2 = 2Cr2O3,
(NH4)2Cr2O7 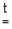 Cr2O3 + N2 + 4H2O.
Cr2O3 + N2 + 4H2O.
Оксид хрома (III) малорастворим и воде и в кислотах. Отвечающий ему гидрооксид обладает амфотерными свойствами:
Cr2(SO4)3 + 6КOH = 2Cr(OH)3¯ + 3К2SO4
(зеленоватый осадок).
Cr(OH)3 растворяется в избытке щелочи:
Cr(OH)3 + NaOH = Na[Cr(OH)4],
И в кислотах:
Cr(OH)3 + 3HCl = CrCl3 + 3H2O.
При прокаливании Сr(OH)3 разлагается:
2Сr(OH)3 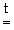 Cr2O3 + 3H2O.
Cr2O3 + 3H2O.
При сплавлении Сr2O3 со щелочами или карбонатами получают метахромиты:
Сr2O3 + 2КOH = 2КCrO2 + H2O ,
Сr2O3 + К2CO3 = 2КCrO2 + CO2 .
Галогениды
Галогениды получают:
2Cr + 3Cl2 = 2CrCl3,
Cr2O3 + 3Cl2 + 3C = 2CrCl3 + 3CO.
2CrCl3(тв) + 3H2S(газ) 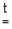 Cr2S3 + 6HCl 2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3H2S + 6NaCl ,
Cr2S3 + 6HCl 2CrCl3 + 3Na2S + 6H2O = 2Cr(OH)3 + 3H2S + 6NaCl ,
CrCl3 + NH3 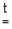 CrN + 3HCl ,
CrN + 3HCl ,
2CrCl3 + 3H2O2 + 10KOH = 2K2CrO4 + 6KCl + 8H2O.
CrCl3 + 3NaHCO3 = Cr(OH)3 + 3CO2 + 3NaCl
Соединения хрома со степенью окисления +6
В этих соединениях по свойствам хром напоминает S+6.
Кислотный оксид CrO3 получают разложением дихромовой кислоты:
K2Cr2O7 + H2SO4(конц) = 2CrO3 + K2SO4 + H2O.
Свойства
Свойства галогенидов передают реакций:
CrO3 является ангидридом хромовой и дихромовой кислот, хорошо растворим в воде:
CrO3 + H2O = H2CrO4,
H2CrO4 + CrO3 = H2Cr2O7.
В кислой среде существуют дихроматы:
| 2K2CrO4 + H2SO4 = | K2Cr2O7 + K2SO4 + H2O, |
| желтый | оранжевый |
а в щелочной - хроматы:
| K2Cr2O7 + 2KOH = | 2K2CrO4 + H2O. |
| оранжевый | желтый |
В кислой среде Cr+6 сильный окислитель:
K2Cr2O7 + 14HCl = 2CrCl3 + 2KCl + 3Cl2 + 7H2O.
6FeSO4 + K2Cr2O7 + 7H2SO4 = 3Fe2(SO4)3 + Cr2(SO4)3 + K2SO4 + 7H2O
в нейтральной среде:
K2Cr2O7 + 3(NH4)2S + H2O = 2Cr(OH)3 ¯+ 3S ¯+ 6NH3 + 2KOH.
Бихромат калия используется как окислитель.
|
из
5.00
|
Обсуждение в статье: Оксиды и пероксиды металлов IIA группы |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы

