 |
Главная |
Экспериментальная часть.
|
из
5.00
|
Задание 1. Качественный анализ сточных вод.
Прежде чем приступить к анализу раствора, необходимо внимательно рассмотреть его окраску, а затем определить рН. По окраске можно сделать предварительный вывод о присутствии некоторых ионов, имеющих окраску, например: Cu2+ (синий), Cr3+ (зеленый или фиолетовый), Ni2+ (зеленый), Co2+ (розовый), MnO4- (фиолетовый), CrO42-(желтый), Сr2O2−7 (оранжевый), Fe3+ (желтый) и др.
В кислом растворе при рН меньше 7, помимо солей сильных кислот и сильных оснований, могут быть свободные кислоты, кислые соли, а также соли, образованные сильными кислотами и слабыми основаниями. Анионов слабых кислот, например, CO32−, SO32−, S2O32−, S2–, в таком растворе нет.
Щелочная реакция исследуемого раствора, т. е. рН больше 7, исключает возможность присутствия в растворе катионов слабых оснований, образующих малорастворимые не амфотерные гидроксиды, например, Al3+, Co2+, Cr3+, Cu2+, Fe3+, Fe2+, Mn2+, Ni2+, Pb2+, Zn2+. Нейтральный раствор может содержать соли, образованные одинаковыми по силе кислотами и основаниями, например, Na2SO4, KNO3, CH3COONH4 и др.
После проведения предварительных испытаний приступают к непосредственному обнаружению катионов и анионов. Предложенные студентам модельные образцы сточных вод содержат небольшое число ионов. Поэтому в целях экономии времени анализ лучше проводить дробным методом, используя для обнаружения приведенные ниже качественные реакции. Анализ проводится непосредственно в отдельных порциях анализируемого раствора в присутствии анионов и катионов других элементов. Порядок обнаружения отдельных ионов не имеет при этом значения.
1. Обнаружение иона Fe3+ взаимодействием с гексацианоферратом (II) калия
Гексацианоферрат (II) калия K4[Fe(CN)6] (желтая кровяная соль) в слабокислых растворах образует с ионами Fe3+ темно-синий осадок «берлинской лазури»:
4Fe3+ + 3[Fe(CN)6]4– → Fe4[Fe(CN)6]3↓.
Другие катионы не мешают проведению этой реакции.
К 1-2 мл пробы сточной воды добавьте 1 мл 2 М раствора HCl и по каплям прибавляйте раствор K4[Fe(CN)6]. Образование темно-синего осадка свидетельствует о присутствии ионов Fe3+.
2. Обнаружение иона Fe2+ взаимодействием с гексацианоферратом (Ш) калия.
Гексацианоферрат (III) калия K3[Fe(CN)6] (красная кровяная соль) в слабокислом растворе образует с ионами Fe2+ синий осадок «турнбулевой сини»:
3Fe2+ + 2[Fe(CN)6]3– → Fe3[Fe(CN)6]2↓
Осадок нерастворим в кислотах, но разлагается щелочами. Эта реакция наиболее характерна для ионов Fe2+. Обнаружению Fe2+ с помощью красной кровяной соли не мешают другие катионы.
К 1-2 мл исследуемой сточной воды добавьте равный объем соляной кислоты и по каплям прибавляйте раствор K3[Fe(CN)6]. Образование синего осадка турнбулевой сини является доказательством присутствия ионов Fe2+.
3. Обнаружение иона Co2+ взаимодействием с роданидом аммония
В слабокислой среде ионы Со2+ образуют с NH4SCN комплексные ионы состава (NH4)2[Co(SCN)4]:
Co2+ + 2NH4+ + 4SCN– → (NH4)2[Co(SCN)4].
При этом раствор окрашивается в синий цвет. Если к полученному раствору прибавить амиловый спирт, то образовавшееся соединение извлекается спиртом и окрашивает его в синий цвет.
Эту реакцию можно провести капельным методом. На фильтровальную бумагу последовательно нанесите каплю анализируемого раствора и раствора NH4SCN. После этого бумагу аккуратно подсушите над плиткой или над пламенем спиртовки. При наличии ионов Со2+ пятно по мере высыхания окрашивается в синий цвет. При таком способе проведения реакции другие катионы не мешают обнаружению Со2+.
4. Обнаружение иона хрома (VI)
Если к раствору, содержащему хромат или бихромат-ионы, прибавить серную или азотную кислоту до рН 2-3, а затем пероксид водорода, то появляется синее окрашивание, обусловленное образованием пероксидного соединения хрома – надхромовой кислоты H2CrO6:
Cr2O2−7 + 4H2O2 + 2H+ → H2CrO6 + 3H2O.
Надхромовая кислота в водной среде быстро разлагается. Поэтому рекомендуется прибавлять несколько капель органического растворителя, в котором надхромовая кислота более устойчива. Эта реакция позволяет обнаружить ионы хрома (VI) в присутствии любых других ионов.
К 1-2 мл исследуемого раствора, подкисленного азотной кислотой, прибавьте несколько капель изоамилового спирта, 1-2 мл Н2О2 и раствор взболтайте. Окрашивание всплывающего наверх слоя органического растворителя в ярко-синий цвет свидетельствует о присутствии в растворе ионов шестивалентного хрома.
5. Обнаружение ионов Cu2+ взаимодействием с тиосульфатом натрия.
Тиосульфат натрия Na2S2O3 в кислой среде при нагревании образует с ионами Cu2+ черный осадок сульфида меди (I) Cu2S:
2Cu2+ + 2S2O32– + 2H2O → Cu2S↓ + S + 2SO42– + 4H+.
Поместите в пробирку 1-2 мл исследуемого раствора, несколько капель 1М раствора H2SO4 и 2-3 кристаллика Na2S2O3. Полученную смесь нагрейте почти до кипения. Образование черного осадка свидетельствует о наличии в растворе ионов Cu2+.
6. Обнаружение аниона Cl– окислением хлорид-ионов и образованием хлора
Сильные окислители (KMnO4, PbO2, KClO3 и др.) в кислой среде окисляют анион Cl– до свободного хлора, например:
10 Cl– + 2 MnO−4 + 16 H+ → 5 Cl2↑ + 2Mn2+ + 8 H2O.
Для обнаружения газообразного хлора можно использовать влажную йодкрахмальную бумагу, которая в присутствии хлора синеет в результате реакции
2I– + Cl2 → I2 + 2Cl– ;
I2 + крахмал → синее окрашивание.
К нескольким каплям испытуемого раствора добавьте такой же объем раствора KMnO4, 2-3 капли концентрированной H2SO4 и нагрейте (под тягой!). Посинение влажной йодкрахмальной бумаги, поднесенной к выходу из пробирки, свидетельствует о наличии хлорид-ионов в анализируемом растворе. Раствор KMnO4 в ходе реакции обесцвечивается, а при избытке окислителя образуется коричнево-бурый диоксид марганца.
7. Обнаружение ионов SO42- образованием малорастворимого сульфата бария.
Наиболее характерным свойством SO42- является образование нерастворимого в кислотах осадка BaSO4. Это свойство отличает сульфат-ион от всех других анионов:
Ba2+ + SO42- → BaSO4↓.
Реакция между SO42- и Ba2+ становится еще более специфичной при добавлении небольшого количества разбавленного раствора KMnO4. При этом образуются смешанные кристаллы красно-фиолетового цвета благодаря частичному захвату KMnO4 осаждающимся сульфатом бария. Окрашенные изоморфные кристаллы не обесцвечиваются при добавлении пероксида водорода, в то время как KMnO4, оставшийся в растворе, восстанавливается с образованием бесцветного Mn2+:
2MnO4- + 5 H2O2 + 6 H+ → 2Mn2+ + 8 H2O + 5 O2.
К 2-3 каплям испытуемого раствора, подкисленного уксусной кислотой, добавьте 2-3 капли 0,01н раствора KMnO4 и 1-2 капли нитрата бария, а через некоторое время 1-2 капли H2O2. Образование окрашенного красно-фиолетового осадка, не обесцвечивающегося при добавлении H2O2, свидетельствует о присутствии в испытуемом растворе сульфат-ионов.
8. Обнаружение ионов NO 3- в заимодействием с сульфатом железа (П). Реакция бурого пятна.
Сульфат железа (II) FeSO4 в присутствии серной кислоты образует с NO3-комплексное соединение [Fe(NO)]SO4 бурого цвета:
6Fe2+ + 2NO3– + 8H+ → 6Fe3+ + 2NO + 4H2O,
Fe2+ + NO + SO42- → [Fe(NO)]SO4.
Реакции мешают анионы Br– и I–, которые дают сходные по окраске Br2 и I2.
В пробирку или на часовое стекло поместите 1-2 кристаллика FeSO4, добавьте 1-2 капли испытуемого раствора, а затем каплю концентрированной H2SO4. Образование вокруг кристаллов бурого кольца свидетельствует о присутствии нитрат-ионов.
Результаты опыта по качественному анализу сточной воды занесите в табл.27.
Таблица 27 – Результаты анализа по определению качественного состава сточной воды.
| Определяемый ион | Уравнение реакции | Условия проведения реакции | Ожидаемый эффект | Наблюдения | Вывод |
Задание 2. Нейтрализация щелочных сточных вод углекислым газом.
Для определения начальной концентрации исследуемой щелочной воды в коническую колбу для титрования налейте 5 мл щелочной воды, добавьте одну каплю фенолфталеина. Оттитруйте пробу 0,1 н раствором HCl до обесцвечивания, рассчитайте концентрацию гидроокиси в растворе по формуле:

где VHCl - объем 0,1 н раствора HCl, израсходованной на титрование, мл; Vпробы - объем пробы, взятой на титрование, мл.
При помощи индикаторной бумаги определите рН. Затем в стакан налейте 200 мл щелочной воды и барботируйте СО2 из колбы Вюрца, предварительно пометив в нее мел и добавляя к нему соляную кислоту 1:4, где происходит реакция
2 HCl + СаСО3 → CaCl2 + H2O + CO2.
По окончании протекания реакции в колбе Вюрца отберите с помощью пипетки с грушей 10 мл воды, определите рН универсальным индикатором и наличие групп ОН- титрованием раствором HCl (аналогично исходной). Данные занесите в табл. 28.
Таблица 28 – Результаты нейтрализации щелочных вод
| № опыта | τ, мин | рН | VHCl, мл | ВOH- | η, % | MCO2 |
Количество углекислого газа, поглощенного щелочным раствором, рассчитайте по уравнению

Степень нейтрализации вычислите по уравнению:
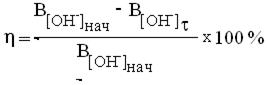
Напишите уравнение реакции нейтрализации.
Задание 3. Оценка устойчивости к загрязнению поверхностных вод.
Естественная устойчивость к загрязнению поверхностных вод зависит от природной специфики водного объекта: водности, скорости течения рек, прочности озер и водохранилищ, минерализации вод и т.д. Используя качественные характеристики водных объектов, оцененные в баллах с учетом коэффициента значимости (Кз), всю гидросеть края по устойчивости объектов поверхностных вод к техногенному загрязнению можно подразделить на три категории.
Ограниченная водность самых малых рек, замедленный водообмен и малая минерализация (100–200 мг/л) делают их весьма неустойчивыми к химическому и бактериологическому загрязнению. Сюда относятся воды всех озер и водохранилищ с минерализацией до 400 мг/л и объемом воды менее 50 млн. м3 независимо от их проточности. Все остальные водоемы и реки, в т.ч. большие со скоростью течения до 0,4 м/с, малой и средней минерализацией, характеризуются как неустойчивые. И лишь большие и быстрые реки обладают относительной устойчивостью к техногенному загрязнению.
Таблица 29 - Критерии оценки устойчивости поверхностных вод к техногенному загрязнению
| Критерии | Водные объекты | Характеристика состояния | Оценочный балл | Коэффициент значимости Кз | Балл с учетом Кз | |
| качественная | количественная | |||||
| Порядок водного объекта | Реки (длина, км.)* | Самые малые | До 25 | 0,5 |
2 | 1 |
| Малые | 25 – 100 | 1,5 | 3 | |||
| Средние | 100 – 500 | 2,5 | 5 | |||
| Большие | Более 500 | 3,0 | 7 | |||
| Озера, водохранилища (млн.м3) | Очень малые | 1 – 10 | 0,5 | 1 | ||
| Малые | 10 – 50 | 1,5 | 3 | |||
| Небольшие | 50 – 100 | 2,5 | 5 | |||
| Большие | Более 100 | 3,0 | 7 | |||
| Миграционные возможности водного объекта | Озера, водохра-нилища (проточность) | Бессточные | 0,28 |
1 | 0,28 | |
| Сточные | 0,85 | 0,85 | ||||
| Проточные | 1,42 | 1,42 | ||||
|
Реки (м/с) | До 0,2 | 2,0 | 2,0 | |||
| 0,2 – 0,4 | 2,57 | 2,57 | ||||
| 0,4 – 0,6 | 3,13 | 3,13 | ||||
| Более 0,6 | 3,71 | 3,71 | ||||
* Длина реки принимается от истоков до выхода из района исследований
Исходя из этого, воды малых рек и небольших водоемов не обладают достаточной устойчивостью к постоянному техногенному прессингу и нуждаются в обязательном выполнении защитных мер, рекомендованных для водоохранных зон малых рек. Ширина водоохранной зоны должна устанавливаться дифференцированно в зависимости от расположения области питания подземных вод, наличия притоков и мелких элементов речной сети, ценных природных объектов, промышленных и транспортных объектов, сложившейся на данном отрезке рекреационной нагрузки. Любое загрязнение в пределах внутренней водоохранной территории (прилегающей к руслу реки) проникает в поверхностный водоток и грунтовый водоносный горизонт, а такие участки характеризуются неудовлетворительной защищенностью подземных вод от проникновения поверхностных загрязнений.
Таблица 30 - Оценка устойчивости объектов поверхностных вод к техногенному загрязнению
| Водные объекты | Критерии оценки | Характеристика состояния | Оценочный балл с учетом Кз | Критерии оценки |
Характеристика состояния | Оценочный балл с учетом Кз | Суммарный балл | Степень устойчивости | |||
| качест-венная | количест-венная | ||||||||||
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | ||
| Реки | Длина водотока, км. |
Самые малые |
до 25 |
1,0 | Скорость течения (м/с) | До 0,2 | 2,0 | 3,0 | Весьма неустойчивый (менее 5) | ||
| 0, –0,4 | 2,57 | 3,57 | |||||||||
| Озера, водохранилища | Объем воды, млн.м3 |
Очень малые |
1–10 |
1,0 | Проточность | Бессточные | 0,28 | 1,28 | |||
| Сточные | 0,85 | 1,85 | |||||||||
| Проточные | 1,42 | 2,42 | |||||||||
|
Малые |
10-50 |
3,0 | Бессточные | 0,28 | 3,28 | ||||||
| Сточные | 0,85 | 3,85 | |||||||||
| Проточные | 1,42 | 4,42 | |||||||||
| Реки | Длина водотока, км. | Малые | 25-100 | 3,0 | Скорость течения (м/с) | 0,2-0,4 | 2,57 | 5,57 | Неустойчивые (5-10) | ||
| Средние | 100-500 | 5,0 | 0,4-0,6 | 2,57 | 7,57 | ||||||
| Большие | Более 500 | 7,0 | 0,4-0,6 | 3,13 | 8,13 | ||||||
| 0,2-0,4 | 2,57 | 9,57 | |||||||||
| Озера, водохранилища | Объем воды, млн.м3 | Небольшие | 50-100 | 5,0 | Проточность | Бессточные | 0,28 | 5,28 | |||
| Сточные | 0,85 | 5,85 | |||||||||
| Проточные | 1,42 | 6,42 | |||||||||
| Большие | Более 100 | 7,0 | Бессточные | 0,28 | 7,28 | ||||||
| Сточные | 0,85 | 7,85 | |||||||||
| Проточные | 1,42 | 8,45 | |||||||||
| Реки | Длина водо-тока, км. |
Большие | 500 Более 500 | 7,0 | Скорость течения (м/с) | 0,4-0,6 Более 0,6 | 3,13 3,71 | 10,13 10,71 | Относительно устойчивые (более 10) | ||
1. Определить устойчивость к техногенному загрязнению реки Енисей.
2. Определить устойчивость к техногенному загрязнению реки Кача.
3. Определить устойчивость к техногенному загрязнению Красноярского водохранилища.
Задание 4. Расчет необходимой степени очистки сточных вод.
Выполнение данной части работы выполняется в соответствии с вариантом, указанным преподавателем.
Задача 1.Найти разбавление сточных вод для глубинного сосредоточенного выпуска в проточное озеро, если даны: скорость течения vп (м/с), средняя глубина в месте выпуска Н (м), расчетный расход сточных вод Q (м3/с). Расчетный створ водопользования расположен на расстоянии L (м).
Данные для решения задачи приведены в табл.27.
Таблица 31 – Варианты задачи
| № п/п | vп | H | Q | L |
| 1 | 0,02 | 30 | 0,32 | 500 |
| 2 | 0,01 | 25 | 0,41 | 800 |
| 3 | 0,02 | 28 | 0,46 | 250 |
| 4 | 0,03 | 42 | 0,53 | 620 |
| 5 | 0,01 | 36 | 0,48 | 780 |
Задача 2.Какова должна быть температура сбрасываемых в водоем сточных вод, если максимальная летняя температура природной воды до места выпуска сточной равна 19°С, а кратность разбавления стоков составляет п = 25?
Результат решения задачи оформите в табл.32.
Таблица 32 - Расчета разбавления сточных вод в озерах и водохранилищах по методам М.А.Руффеля и Н.Н.Лапшева.
| Рассчитываемый параметр | формула | Численное значение |
| 1 | 2 | 3 |
| Диаметр отверстия выпуска, принимая vo = 2,5 м/с | do = 4 • Q/3,14 • 2,5 | |
| Параметр, зависящий от степени проточности водоема и нагрузки сточных вод на него | р = vn/(0,000015v0 + vn) | |
| Параметр, определяемый относительной глубиной водоема |

| |
| Наименьшее разбавление, наблюдающееся на расстоянии от места выпуска сточных вод | n = A(0,2L/d0)ps |
Таблица 33 - Расчет температуры сбрасываемых в водоем сточных вод
| Рассчитываемый параметр | формула | Численное значение |
| Температура сбрасываемых вод Тст | Тст ≤ пТдоп+Тмакс |
Требование к содержанию отчета. Отчеты по каждому заданию оформляются в соответствии с указанными выше требованиями.
Контрольные вопросы.
1. Охарактеризуйте роль, которую играет законодательство в комплексном использовании и охране водных ресурсов?
2. Что такое мониторинг водных объектов и кто его проводит?
3. Для чего составляются схемы комплексного использования и охраны вод? Их виды? Что такое бассейновое соглашение?
4. Перечислите мероприятия по охране поверхностных вод?
5. Для чего установлены водоохранные воды? Какую роль играют водоохранные лесные насаждения?
6. Какие сооружения входят в систему искусственной биологической очистки?
7. Перечислите мероприятия, проводимые с целью борьбы с истощением и загрязнением сточных вод.
8. Почему в настоящее время так остро стоит проблема охраны малых рек?
9. Перечислите методы очистки сточных вод предприятия.
10. Какие основные устройства применяются при механической очистке сточных вод?
11. Какие процессы используются при химической и физико-химической очистке сточных вод?
12. Охарактеризуйте роль бессточных производств в решении проблемы охраны водоемов.
Заключение
Выполнение лабораторных работ по дисциплине «Экология» является обязательной составной частью освоения дисциплины и служит базой для самостоятельной внеаудиторной работы и успешного прохождения промежуточной аттестации по дисциплине.
Успешное освоение дисциплины позволит студенту в полном объеме освоить последующие дисциплины учебного плана.
| ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Л3.4 | М. С. Спиридонова, М. С. Шарапаева | Экология [Текст] : методические указания к выполнению контрольных работ по курсу для студентов заочной формы обучения.- | Красноярск :КрИЖТИрГУПС, 2013 | 98 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Л3.5 | М. С. Спиридонова, М. С. Шарапаева | Экология [Электронный ресурс] : методические указания к выполнению контрольных работ по курсу для студентов заочной формы обучения .- http://irbis.krsk.irgups.ru/cgi-bin/irbis64r_opak81/cgiirbis_64.exe?&C21COM=2&I21DBN=IBIS&P21DBN=IBIS&Image_file_name=%5CFul%5C812.pdf&IMAGE_FILE_DOWNLOAD=1 | Красноярск :КрИЖТИрГУПС, 2013 | 100 % online | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Л3.6 | Н.Г. Чистова | Экология. [Электронный ресурс] : Методические указания для выполнения лабораторных работ по курсу экологии.- http://irbis.krsk.irgups.ru/cgi-bin/irbis64r_opak81/cgiirbis_64.exe?&C21COM=2&I21DBN=IBIS&P21DBN=IBIS&Image_file_name=%5CFul%5C812.pdf&IMAGE_FILE_DOWNLOAD=1 | Красноярск :КрИЖТИрГУПС, 2017 | 100 % online | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Л3.7 | Е. А. Корякина, Н. А. Коновалова ; ред. О. Б. Кузнецова | Природопользование в железнодорожной отрасли [Электронный ресурс] : методические указания по выполнению контрольной работы.- http://irbis.krsk.irgups.ru/cgi-bin/irbis64r_opak81/cgiirbis_64.exe?&C21COM=2&I21DBN=IBIS&P21DBN=IBIS&Image_file_name=%5CFul%5C46_yim.pdf&IMAGE_FILE_DOWNLOAD=1 | Чита :ЗабИЖТИрГУПС, 2013 | 100 % online | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Л3.8 | Н.М.Борщева | Лабораторные работы по экологии [Электронный ресурс] : Учебно-методическое пособие. - http://cito-web.yspu.org/link1/metod/met78/met78.html | Ярославль ЯГПУ, 2015 | 100 % online | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|
из
5.00
|
Обсуждение в статье: Экспериментальная часть. |
|
Обсуждений еще не было, будьте первым... ↓↓↓ |

Почему 1285321 студент выбрали МегаОбучалку...
Система поиска информации
Мобильная версия сайта
Удобная навигация
Нет шокирующей рекламы
(0.011 сек.)

